题目内容
(9分)有一瓶溶液只含Cl-、CO32—、SO42—、Na+、NH4+、K+、Mg2+七种离子中的某几种。经如下实验:
① 原溶液加入过量NaOH溶液,产生白色沉淀;
② 将①所得溶液加热,放出使湿润的红色石蕊试纸变蓝的气体;
③ 原溶液中加BaCl2溶液不产生沉淀。
④ 原溶液中加AgNO3溶液产生白色沉淀,再加稀硝酸白色沉淀不溶解。
回答下列问题:
(1)试分析原溶液中一定含有的离子是 ,一定不含有的离子是  。
。
(2)请写出实验①、②、④有关反应的离子方程式:
①产生白色沉淀 ;
②产生气体 ;
④产生白色沉淀 。
(3)有同学认为实验④可以省略,你认为呢?(填“可以”或“不可以”) ,
并说明理由 。
(9分)(1) Mg2+、NH4+、Cl-; CO32-、SO42-;(每空2分)
Mg2+、NH4+、Cl-; CO32-、SO42-;(每空2分)
(2)①Mg2++2OH-=Mg(OH)2↓、②NH4++OH-△ NH3↑+H2O、④Ag++ Cl― =" AgCl" ↓
(3)可以 溶液显电中性有阳离子存在必有阴离子存在(每空1分)
解析

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目

 回答下列问题:
回答下列问题: 、CO
、CO 、SO
、SO 、Na
、Na 、K
、K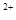 六种离子中的某几种。经实验:
六种离子中的某几种。经实验: 白色沉淀;
白色沉淀; 回答下列问题:
回答下列问题: