题目内容
14. 丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.
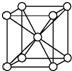
丙炔腈(H-C=C-CN,沸点42.5℃)是一种星际分子,实验室可通过丙炔醇用铬酸酐氧化、盐酸羟胺肟化、再脱水来制备.(1)铬元素的基态原子核外电子排布式为1s22s22p63s23p63d54s1;铬的晶胞结构如图所示,铬晶体中包含的铬原子数与配位数之比为1:4.
(2)H-C=C-CN中碳原子的杂化类型为sp;丙炔腈气化时,需克服的作用力为分子间作用力.
(3)盐酸羟胺的化学式为[NH3OH]Cl,与[NH3OH]+互为等电子体的一种分子为CH3OH(写分子式).
(4)氰基辛炔(HC9N)也是一种星际分子,该分子中处于同一直线上的原子数目最多有11个,1mol HC9N分子中含有σ键的数目为10NA.
分析 (1)Cr的原子序数为24,根据能量最低原理书写基态原子的电子排布式;根据均摊法计算晶胞中原子数,位于晶胞顶点的原子被8个晶胞共用,则配位数为8;
(2)根据C原子的价层电子对数判断;分子晶体气化时破坏分子间作用力;
(3)原子个数、价电子数相等的微粒是等电子体;
(4)氰基辛炔(HC9N),其结构式为HC≡C-C≡C-C≡C-C≡C-C≡N,根据三键的结构特点分析;1个单键中含有1个σ键,三键中含有1个σ键和1个π键.
解答 解:(1)Cr的原子序数为24,电子排布式为:1s22s22p63s23p63d54s1;晶胞中铬原子的数目为1+8×$\frac{1}{8}$=2,位于晶胞顶点的原子被8个晶胞共用,则配位数为8,所以铬晶体中包含的铬原子数与配位数之比为2:8=1:4;
故答案为:1s22s22p63s23p63d54s1;1:4;
(2)H-C=C-CN中碳原子的价层电子对数均为2,即碳原子的杂化类型为sp;H-C=C-CN属于分子晶体,分子晶体气化时破坏分子间作用力;
故答案为:sp;分子间作用力;
(3)盐酸羟胺的化学式为[NH3OH]Cl,与[NH3OH]+互为等电子体的一种分子为CH3OH;
故答案为:CH3OH;
(4)氰基辛炔(HC9N),其结构式为HC≡C-C≡C-C≡C-C≡C-C≡N,三键为直线结构,且均直接相连,则所有原子都在同一直线上,即分子中处于同一直线上的原子有11个;1个单键中含有1个σ键,三键中含有1个σ键和1个π键,则分子中含有10个σ键,所以1mol HC9N分子中含有σ键的数目为10NA;
故答案为:11;10NA.
点评 本题考查了电子排布式、杂化类型的判断、等电子体、有机物的结构与性质,侧重电子排布式、炔烃性质及直线结构的考查,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案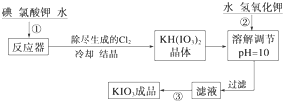
(1)已知步骤①反应器发生的反应中,单质碘和氯酸钾的物质的量之比为6:11,则反应器中发生反应的化学方程式为6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑.
(2)步骤②中调节pH=10的目的是使KH(IO3)2转化为KIO3.
参照碘酸钾的溶解度:
| 温度/℃ | 20 | 40 | 60 | 80 |
| KIO3 g/100g H2O | 8.08 | 12.6 | 18.3 | 24.8 |
(3)检验加碘食盐中的碘元素,学生甲利用碘酸钾与碘化钾在酸性条件下发生反应,然后用四氯化碳检验生成的碘单质时,甲应观察到的明显现象有液体分层,下层液体呈现紫红色.
学生乙对纯净的NaCl进行了如下实验:取1g纯净的NaCl,加3mL水配成溶液,然后滴入5滴淀粉溶液和1mL 0.1mol•L-1 KI溶液,振荡,溶液无变化,然后再滴入1滴1mol•L-1的H2SO4,振荡,一段时间后溶液变浅蓝色.请推测实验中产生蓝色现象的可能原因,用离子方程式表示4I-+4H++O2═2I2+2H2O.
(4)学生丙查阅有关食品碘强化剂的资料后知道,碘酸钙也是一种允许使用的食品碘强化剂,它是一种白色结晶或结晶性粉末,难溶于水和乙醇.丙同学在氯化钙溶液中加入理论量的碘酸钾溶液,反应生成的沉淀经水洗后,室温下干燥得碘酸钙晶体,加热至160~540℃变成无水物,此时固体质量为原晶体质量的78.3%,写出制备碘酸钙晶体的离子方程式:Ca2++2IO${\;}_{3}^{-}$+6H2O═Ca(IO3)2•6H2O;检验沉淀已经洗涤干净的方法是在最后一次洗涤液中加入硝酸银溶液,若无白色沉淀说明已经洗涤干净.
不同铬的化合物或离子的水溶液的颜色如下:
| 离子或化合物 | Cr2O72- | Cr(OH)3 | Cr(OH)4- | Cr3+ | CrO42- |
| 颜色 | 橙色 | 灰蓝色 | 绿色 | 绿色 | 黄色 |

(1)反应①的还原剂是Zn,反应②的离子方程式为Cr3++3OH-═Cr(OH)3↓.
(2)在K2Cr2O7橙色溶液中逐滴加入NaOH溶液,溶液逐渐变为黄色,该反应的离子方程式为Cr2O72-+2OH-═2CrO42-+H2O.
(3)将KCl和CrCl3两种固体混合物共熔制得化合物X,将0.0035mol X中的Cr元素全部氧化成Cr2O72-,得到的Cr2O72-与过量的KI反应生成0.0105mol I2,反应的离子方程式为Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
另取0.0035mol X溶于水中,当加入0.0315mol AgNO3时,恰好沉淀完全.则表示X组成的化学式为K3Cr2Cl9.
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 用pH计测得某溶液的pH为2.2 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 可用25mL碱式滴定管量取20.00mL KMnO4溶液 |
| A. | 25℃时,l L pH=13的 Ba(OH)2溶液中含有的OH-数为0.2 NA | |
| B. | 18g D2O中含有的质子数为9NA | |
| C. | Fe在少量Cl2中燃烧生成0.5 mol 产物,转移的电子数为NA | |
| D. | 标准状况下,11.2LCCl4含有的分子数为0.5 NA |
| A. | c(OH-)>c(H+)的溶液 | |
| B. | 含OH-的溶液 | |
| C. | pH=3的CH3COOH与pH=11的NaOH溶液等体积混合 | |
| D. | 滴加甲基橙后溶液显红色 |
 某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.
某实验小组用0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol•L-1 NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母):abe.
| 名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应中和热的热化学方程式:(中和热为57.3kJ•mol-1)$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.6 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol•L-1 NaOH溶液和0.50mol•L-1硫酸溶液的密度都是1g•cm-3,中和后生成溶液的比热容c=“4.18“J•(g•℃)-1.则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ•mol-1有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
④实验中改用60mL0.5mol/L盐酸跟50mL0.55moi/L氢氧化钠进行反应,与上述实验相比,所放出的热量不相等(填相等或不相等,下同),所求的中和热相等,简述理由中和热是指酸跟碱发生中和反应生成lmolH2O所放出的热量,它与酸、碱的用量无关.
 为了消除大气污染,节约燃料,缓解能源危机,化学家提出了利用太阳能促使燃料循环使用的构想图(见图),该设想主要需解决的问题是( )
为了消除大气污染,节约燃料,缓解能源危机,化学家提出了利用太阳能促使燃料循环使用的构想图(见图),该设想主要需解决的问题是( )| A. | 使燃料充分燃烧,尽可能产生较多的燃烧热,充分利用燃料 | |
| B. | 不使燃料不完全燃烧时产生的CO等有害气体进入大气,以消除污染 | |
| C. | 利用太阳能使燃烧产物经化学反应重新组合,使之变成CH4、CH3OH、NH3等 | |
| D. | 在太阳能的作用下燃料燃烧时不产生燃烧产物 |