题目内容
9.已知某温度下CuSO4的溶解度为25g,取该温度下的饱和溶液200g,再加入16gCuSO4固体,则溶液中析出晶体的质量约为( )| A. | 4g | B. | 25g | C. | 29g | D. | 30g |
分析 取该温度下的饱和溶液200g,再加入16gCuSO4固体,加入的16g硫酸铜会形成结晶水合物全部析出,同时原饱和溶液中由于水的减少,也会析出硫酸铜晶体,依据原溶液中析出的硫酸铜和析出的水是原饱和溶液组成,结合溶解度概念概念计算.
解答 解:取该温度下的饱和溶液200g,再加入16gCuSO4固体,加入的16g硫酸铜会形成结晶水合物全部析出,同时原饱和溶液中由于水的减少,也会析出硫酸铜晶体,依据原溶液中析出的硫酸铜和析出的水是原饱和溶液组成,设析出硫酸铜晶体CuSO4•5H2O质量为xg,则
则($\frac{160}{250}$x-16):$\frac{90}{250}$x=25:100,
解得x≈29g,
故选C.
点评 本题考查了溶解度的概念分析判断和计算应用,主要是析出晶体的理解应用,掌握溶解度的计算方法是关键,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.已知短周期元素的离子aB+、cC3-、dD-都具有相同的电子层结构.则下列叙述正确的是( )
| A. | 原子半径 B>D>C | |
| B. | 原子序数 d>c>a | |
| C. | 离子半径 C>D>B | |
| D. | 原子结构的最外层电子数目 B>D>C |
17.下列说法不正确的是( )
| A. | ⅠA元素的电负性从上到下逐渐减小,ⅦA元素的第一电离能从上到下逐渐减小 | |
| B. | 电负性的大小可以作为衡量元素的金属性和非金属性强弱的尺度 | |
| C. | 氢原子中只有一个电子,故氢原子只有一个原子轨道 | |
| D. | NaH的存在能支持可将氢元素放在ⅦA的观点 |
4.下列各组物质间反应,其中水既不作氧化剂又不作还原剂的氧化还原反应是( )
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
①F2和H2O ②Na和H2O ③Na2O2和H2O ④P2O5和H2O ⑤Na2O和H2O
⑥Cl2和H2O ⑦NO2和H2O ⑧Al和NaOH溶液.
| A. | ③④⑤⑥⑦ | B. | ①⑤⑦ | C. | ②③⑤⑧ | D. | ③⑥⑦ |
1.某元素X最高价含氧酸的相对分子质量为98,且X的氢化物的分子式不是H2X,则下列说法正确的是( )
| A. | X的最高价含氧酸的分子式可表示为H3XO4 | |
| B. | X是第二周期VA族元素 | |
| C. | X是第三周期ⅥA族元素 | |
| D. | X的最高化合价为+4 |
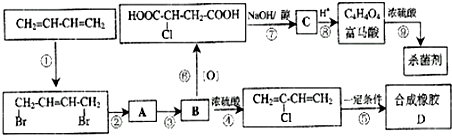

 .
.
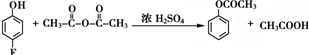 ;反应⑤的化学方程式为
;反应⑤的化学方程式为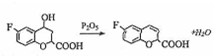 .
.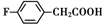 、
、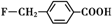 .
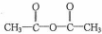
. 和乙酸酐为原料制备
和乙酸酐为原料制备 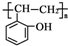 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下: 2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有:
2015年3月,全国“两会”代表委员就我国“雾霾”治理积极建言献策.科学家研究表明氮氧化物与悬浮在大气中的盐粒子相互作用时能产生“二次雾霾”,涉及的反应有: