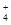题目内容
下列事实、离子方程式及其对应关系均正确的是.
| A.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H++4I-+O2=2I2+2H2O |
B.向K2Cr2O7溶液中滴加少量浓硫酸,溶液变为黄色: Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+ 2CrO42-(黄色)+2H+ |
| C.0.01 mol·L-1NH4Al(SO4)2溶液与0.02 mol·L-1Ba(OH )2溶液等体积混合有白色沉淀生成: Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
D.用铜电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
A
试题分析:A.符合客观事实,拆写符合离子方程式的原则。正确。B.向K2Cr2O7溶液中滴加少量稀硫酸来酸化。否则浓硫酸有氧化性,反应原理不清楚。错误。C.Al3++2SO42-+2Ba2++4OH-+ NH4+=2BaSO4↓+Al(OH)3↓+NH3·H2O,错误。D.用铜电极电解饱和食盐水,由于Cu电极是活性电极,所以在阳极是Cu失去电子变为Cu2+进入溶液;反应的方程式是Cu+2H2O
 Cu( OH)2↓+H2↑.错误。
Cu( OH)2↓+H2↑.错误。
练习册系列答案
相关题目
|
(16分)粉煤灰,是从煤燃烧后的烟气中收捕下来的细灰,粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物为:SiO2、Al2O3,还含有FeO、Fe2O3等。现将提取粉煤灰中Al、Si等元素,某科研小组的同学设计了如下工艺流程:  请回答下列问题: (1)操作i所需要的玻璃仪器有: (填序号)。 a.铁架台 b.烧杯 c.冷凝管 d.玻璃棒 e.集气瓶 f.分液漏斗 g.漏斗 (2)写出粉煤灰与过量NaOH溶液反应的离子方程式 。 (3)写出向固体A中加入过量稀H2SO4和过量H2O2时发生的离子反应方程式 。 (4)写出生成固体H的离子方程式 。 (5)该科研小组的同学准备用0.1 mol·L-1KSCN溶液和0.5000mol·L-1KI溶液滴定溶液B,以测定粉煤灰中Fe元素的含量: ①为减小实验误差,由固体A制备溶液B过程中煮沸的目的是 (请用化学方程式表示)。 ②判断滴定终点的现象为 。 ③将溶液B配制成250mL溶液后,取出25.00mL装入锥形瓶中,再滴入1~2滴KSCN溶液进行滴定,滴定过程中使用KI溶液的量如下表所示:
④若滴定操作太慢,则滴定结果 (填“偏小”、“偏大”或“无影响”);原因是 (请用离子方程式及简单的文字描述)。 |
 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时: 


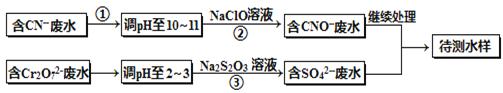
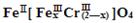 (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。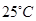 时,亚磷酸(
时,亚磷酸( ,二元酸)的
,二元酸)的 ,
,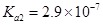 ;
; )的
)的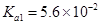 ,
,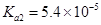

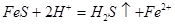
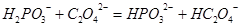
 CO32-+H3O+
CO32-+H3O+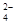 +4H+
+4H+