题目内容
4.如图所示的框图中,A~I都是由短周期元素组成的常见物质.其中A是气体,它的水溶液呈碱性;氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒;单质E可作半导体材料.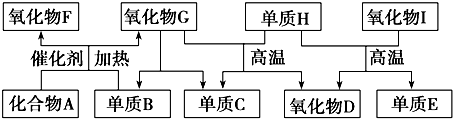
(1)化合物A的化学式是NH3,氧化物G的电子式是
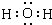 .
.(2)组成单质E的元素在元素周期表中的位置是第三周期IVA族,H+I反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
(3)标准状况下,将2.24L氧化物F和1.68L单质B同时通入1L氧化物G中(反应前后溶液体积的变化忽略不计),发生反应的化学方程式为4NO+3O2+2H2O=4HNO3,所得溶液的pH=1.此时再向溶液中通入2.24L化合物A,完全反应后所得溶液的pH<7 (填“>7”、“<7”或“=7”),用离子方程式表示其原因:NH4++H2O?NH3•H2O+H+.
分析 A是气体,它的水溶液呈碱性,应为NH3,与单质B在催化剂条件下反应生成两种氧化物,则B为O2,氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO,D为CO,G为H2O,结合转化关系可知C为H2,H为C,单质E可作半导体材料,应为Si,则I为SiO2,结合对应物质的性质以及题目要求可解答该题.
解答 解:A是气体,它的水溶液呈碱性,应为NH3,与单质B在催化剂条件下反应生成两种氧化物,则B为O2,氧化物D和氧化物F都易与人体血液中的血红蛋白结合而使人中毒,则F为NO,D为CO,G为H2O,结合转化关系可知C为H2,H为C,单质E可作半导体材料,应为Si,则I为SiO2,
(1)由以上分析可知A为NH3,G为H2O,电子式为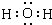 ,
,
故答案为:NH3;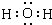 ;
;
(2)E为Si,位于周期表第三周期IVA族,H+I反应的化学方程式为SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,
故答案为:第三周期IVA族;SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑;
(3)将2.24L氧化物F和1.68L单质B的物质的量之比为2.24:1.68=4:3,通入水中发生4NO+3O2+2H2O=4HNO3,n(HNO3)=n(NO)=0.1mol,
c(HNO3)=0.1mol/L,则pH=1,此时再向溶液中通入2.24L化合物A,得打硝酸铵溶液,为强酸弱碱盐,水解呈酸性,离子方程式为NH4++H2O?NH3•H2O+H+,
故答案为:4NO+3O2+2H2O=4HNO3;1;<7;NH4++H2O?NH3•H2O+H+;
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意把握物质的性质以及转化关系,为解答该题的关键,难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案①用托盘天平称取11.7g食盐
②用量筒量取5.26mL盐酸
③用广泛pH试纸测得溶液的pH是3.5
④用25mL酸式滴定管量出15.80mL的KMnO4溶液.
| A. | ②③ | B. | ①③ | C. | ①④ | D. | 只有① |

已知:①A、B、C、D、G含有同种元素X.
②
| 物质 | 纯A (单质) | B(溶液) | C(固体) | D(固体) | G(溶液) |
| 颜色 | 银白色 | 棕黄色 | 红褐色 | 红棕色 | 浅绿色 |
试回答下列问题:
(1)元素X在元素周期表中的位置为第四周期第Ⅷ族,D的化学式为Fe2O3.
(2)G生成C的过程中出现的现象为先产生白色沉淀,逐渐变为灰绿色,最后变为红褐色.
(3)写出下列反应的化学方程式:
E→A4H2+Fe3O4$\frac{\underline{\;\;△\;\;}}{\;}$3Fe+4H2O;A→B2Fe+3Cl2$\frac{\underline{\;点燃\;}}{\;}$2FeCl3.
(4)B→F的离子方程式为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+;G与Cl2反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-.
| A. | Fe(SCN)3溶液中加入固体KSCN后颜色变深 | |
| B. | 棕红色NO2加压后颜色先变深后变浅 | |
| C. | SO2催化氧化成SO3的反应,往往需要加入过量的氧气 | |
| D. | H2、I2、HI平衡混合气加压后颜色变深 |
| A. | 苯 | B. | 己烯 | C. | CCl4 | D. | KI |
| A. | 质子数是27 | B. | 中子数是27 | C. | 电子数是13 | D. | 质量数是13 |
| A. |  | B. |  | C. |  | D. |  |
 A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.
A、B、C是单质,其中A是金属,各种物质间的转化关系如图所示.