题目内容
已知FeS2与某浓度的HNO3反应时生成Fe(NO3) 3、H2SO4和某单一的还原产物,若FeS2和参与反应的HNO3的物质的量之比为1:8,则该反应的还原产物是
| A.NO2 | B.NO | C.N2O | D.NH4NO3 |
B
试题分析:这是一道有关氧化还原反应的问题,应遵循电子守恒,在反应中,硫化亚铁是还原剂,假设硫化亚铁是1mol,那么铁失去1 mol的电子,而2 mol硫由负一价升高到正六价,失去14mol的电子,总共失去15 mol的电子,这些电子都是由硝酸得到的,8 mol的硝酸中有3 mol是用来结合三价铁离子的,还剩余5mol,总共得到15 mol的电子,那么每摩尔的硝酸要得到3mol的电子,化合价就会从正五价变成正二价。因此选B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
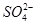 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )