题目内容
亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示(部分夹持装置略)。
已知:室温下,①2NO+Na2O2→2NaNO2 ②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;
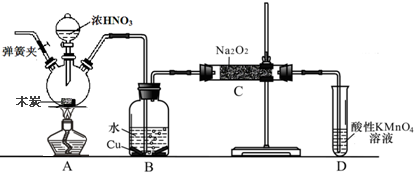
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和 ,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称 。
(5)写出检验C产物中是否含碳酸钠的方法 。
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
已知:室温下,①2NO+Na2O2→2NaNO2 ②3NaNO2+3HCl→3NaCl+HNO3+2NO↑+H2O;

③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
完成下列填空:
(1)写出浓硝酸与木炭反应的化学方程式 。
(2)B中观察到的主要现象是 ,D装置的作用是 。
(3)检验C中产物有亚硝酸钠的方法是 。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和 ,为避免产生这些副产物应在B、C装置间增加装置E,画出E并注明E中盛放的药品名称 。
(5)写出检验C产物中是否含碳酸钠的方法 。
(6)将1.56g过氧化钠完全转化成为亚硝酸钠,理论上至少需要木炭 g。
(1)C+4HNO3(浓)=加热=CO2+4NO2+2H2O
(2)铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
(4)氢氧化钠 干燥管 碱石灰
(5)取样,加入酸性高锰酸钾溶液,若有使澄清石灰水变浑浊的气体产生,则有碳酸钠
(6)0.36g(关系式法C~4NO2~4/3 NO~2/3 Na2O2 )
(2)铜片逐渐溶解,溶液变为蓝色,有无色气体产生 吸收未反应的NO
(3)取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色
(4)氢氧化钠 干燥管 碱石灰
(5)取样,加入酸性高锰酸钾溶液,若有使澄清石灰水变浑浊的气体产生,则有碳酸钠
(6)0.36g(关系式法C~4NO2~4/3 NO~2/3 Na2O2 )
试题分析:(1)写出浓硝酸与木炭在加热条件下发生氧化还原反应的化学方程式C+4HNO3(浓)=加热=CO2+4NO2+2H2O。
(2)A中生成的二氧化氮进入B中并与水反应,生成了硝酸,硝酸和铜反应,观察到的主要现象是铜片逐渐溶解,溶液变为蓝色,有无色气体产生,由于一氧化氮有毒,D装置的作用是吸收未反应的NO。
(3)检验C中产物有亚硝酸钠的方法是取样,加入稀盐酸,产生无色气体,遇到空气变为红棕色。
(4)经检验C产物中除亚硝酸钠外还含有副产物碳酸钠和氢氧化钠,氢氧化钠是由水和过氧化钠生成,为避免产生这些副产物应在B、C装置间增加干燥装置E,药品名称碱石灰放在干燥管中。
(5)检验碳酸根的方法:取样,加入酸性高锰酸钾溶液,若有使澄清石灰水变浑浊的气体产生,则有碳酸钠。
(6)将1.56g过氧化钠是0.02mol,完全转化成为亚硝酸钠,根据①2NO+Na2O2→2NaNO2,生成NaNO2 0.04mol,C+4HNO3(浓)=CO2+4NO2+2H2O,3NO2+2H2O=2HNO3 + NO +H2O,得出关系式1.5C---2NaNO2,可求得碳的物质的量为0.03mol,理论上至少需要木炭0.36g。

练习册系列答案
相关题目
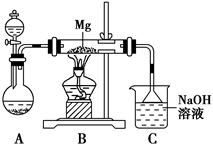
 2MgSO3+S;丙同学的推测是:3Mg+SO2
2MgSO3+S;丙同学的推测是:3Mg+SO2
 气体,并防止倒吸
气体,并防止倒吸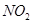 ,如果“b进a出”可用于收集
,如果“b进a出”可用于收集
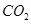 气体,现象是先出现白色沉淀,后变澄清
气体,现象是先出现白色沉淀,后变澄清