题目内容
【题目】某化学研究性学习小组探究Fe3+和SO![]() 之间发生的反应。
之间发生的反应。
(1)取5 mL FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,观察到溶液颜色由黄色变为红棕色,继续加入Na2SO3浓溶液至过量,溶液颜色加深,最终变为红褐色。无气泡产生,无沉淀生成。这种红褐色液体是_________。
(2)除了观察到以上的现象外,有成员提出了另一种可能:发生氧化还原反应。反应的离子方程式为________________________。
(3)研究性学习小组设计了两种实验方案证明发生了氧化还原反应。请把实验方案补充完整:
(方案一)检验溶液中含有Fe2+证明发生了氧化还原反应
(方案二)检验溶液中含有____证明发生了氧化还原反应
实验用品:0.1 mol·L-1 BaCl2、3 mol·L-1 盐酸、3 mol·L-1 硝酸、新制氯水、20% KSCN、0.5 mol·L-1 KI;试管若干、胶头滴管若干。
Ⅰ.预处理:将(1)中获得的混合物放在如图装置中处理足够时间,该操作名称为____。
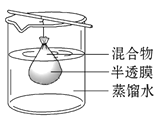
Ⅱ.检验过程
①简述证明溶液中含有Fe2+的操作方法:_________________________________________;
②检验溶液中含有另一种离子可选用的试剂是:_______________________。
【答案】Fe(OH)3胶体SO32-+2Fe3++H2O===2Fe2++SO42-+2H+SO42-渗析取适量烧杯中的溶液于试管中,滴加2~3滴20% KSCN溶液,没有明显变化,再加入足量氯水(或3 mol/L硝酸),溶液变血红色,证明溶液中含有Fe2+3 mol·L-1 盐酸、0.1 mol·L-1 BaCl2
【解析】
(1)FeCl3是强酸弱碱盐,水解使溶液显酸性; Na2SO3是强碱弱酸盐水解使溶液显碱性。当二者混合时,对彼此的水解起到了促进作用,所以产生了红褐色的氢氧化铁胶体。(2)如果二者混合发生氧化还原反应,则反应的方程式是:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。在该反应中氧化剂Fe3+生成还原产物Fe2+;还原剂SO32-氧化为氧化产物SO42-。所以证明发生了氧化还原反应可以通过检验溶液中含有Fe2+或检验溶液中含有SO42-。提纯胶体的方法是渗析;方案一:利用Fe3+遇到SCN-产生血红色溶液,而Fe2+遇到SCN-不会发生反应,Fe2+遇到氯水被氧化为Fe3+后产生血红色溶液来检验溶液中含有Fe2+。方案二:向溶液中加入足量3mol/L的盐酸使SO32-转化为SO2气体,再滴加0.1mol/L BaCl2溶液,若产生白色沉淀,就证明含有SO42-。
(1)FeCl3是强酸弱碱盐,水解使溶液显酸性; Na2SO3是强碱弱酸盐水解使溶液显碱性。当二者混合时,对彼此的水解起到了促进作用,产生了红褐色的氢氧化铁胶体,所以红褐色液体是氢氧化铁胶体。(2)如果二者混合发生氧化还原反应,Fe3+被还原为Fe2+、SO32-被氧化为SO42-,则反应的离子方程式是:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+。(3)在该反应中还原产物Fe2+、氧化产物SO42-。所以证明发生了氧化还原反应可以通过检验溶液中含有Fe2+或检验溶液中含有SO42-。Ⅰ.提纯胶体的操作名称是渗析。Ⅱ. ①证明溶液中含有Fe2+的操作方法是:取适量烧杯中的溶液于试管中,滴加2~3滴20% KSCN溶液,没有明显变化,再加入足量氯水(或3 mol/L硝酸),溶液变血红色,证明溶液中含有Fe2+;②检验溶液中含有SO42-的方法是:向溶液中加入足量3mol/L的盐酸使SO32-转化为SO2气体,再滴加0.1mol/L BaCl2溶液,若产生白色沉淀,就证明含有SO42-,所以可选用的试剂是:3 mol·L-1 盐酸、0.1 mol·L-1 BaCl2。