题目内容
19.已知R2+核内有x个中子,R原子的质量数为m,则ngR2+所含电子的总物质的量是( )| A. | n(m−x+2)mn(m−x+2)m mol | B. | n(m−x)mn(m−x)m mol | C. | m−x+2m−nm−x+2m−n mol | D. | n(m−x−2)mn(m−x−2)m mol |
分析 元素R的质量数为m,R2+离子的原子核内有x个中子,则R的质子数为m-x,所以R2+中核外电子数为m-x-2,计算出n克R2+离子的物质的量,以此解答该题.
解答 解:元素R的质量数为m,R2+离子的原子核内有x个中子,则R的质子数为m-x,所以R2+中核外电子数为m-x-2,
n(R2+)=nmnmmol,
则n克R2+离子所含电子的总物质的量是nmnmmol×(m-x-2).
故选D.
点评 本题考查物质的量的相关计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握原子结构特点以及相关计算公式的运用,难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
9.下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是( )
| A. | SO3+H2O═H2SO4 | B. | Cl2+H2O═HCl+HClO | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2Na+2H2O═2NaOH+H2↑ |
10.下列物质中,属于强电解质的是( )
| A. | CH3COOH | B. | H2O | C. | NH3•H2O | D. | NaOH |
14.下列说法中不正确的是( )
| A. | 离子化合物中一定含有金属元素 | |
| B. | 只由共价键构成的物质不一定是共价化合物 | |
| C. | 原煤、天然气属于一次能源,而电力、蒸汽则属于二次能源 | |
| D. | 锌锰电池是一次电池,而铅蓄电池则是二次电池 |
4.下列物质在水溶液中能够全部电离的是( )
| A. | H2O | B. | NH3•H2O | C. | CH3COONH4 | D. | CH3COOH |
11.可以将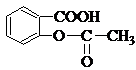 转变为
转变为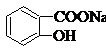 的方法是( )
的方法是( )
①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液
③与足量的NaOH溶液共热 ④与稀H2SO4共热后,加入足量的NaHCO3.
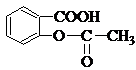 转变为
转变为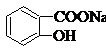 的方法是( )
的方法是( )①与足量的NaOH溶液共热,再通入CO2 ②与稀硫酸共热后,加入足量的NaOH溶液
③与足量的NaOH溶液共热 ④与稀H2SO4共热后,加入足量的NaHCO3.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ②④ |
14.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.请用化学用语回答下列问题:
(1)X元素单质分子结构式N≡N
(2)X、Y、Z三种元素最低价氢化物的沸点最高的是H2O
(3)写出两种由X、Y和氢三种元素形成的不同类别的化合物的化学式:HNO3、NH3•H2O (每个类别任写一种)
(4)Z元素的单质与水反应的化学方程式2F2+2H2O=4HF+O2
(5)W、T的最高价氧化物对应的水化物酸性较弱的是H2GeO3.
| X | Y | Z | |
| W | |||
| T |
(2)X、Y、Z三种元素最低价氢化物的沸点最高的是H2O
(3)写出两种由X、Y和氢三种元素形成的不同类别的化合物的化学式:HNO3、NH3•H2O (每个类别任写一种)
(4)Z元素的单质与水反应的化学方程式2F2+2H2O=4HF+O2
(5)W、T的最高价氧化物对应的水化物酸性较弱的是H2GeO3.

 .
.