题目内容
14.如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.请用化学用语回答下列问题:| X | Y | Z | |
| W | |||
| T |
(2)X、Y、Z三种元素最低价氢化物的沸点最高的是H2O
(3)写出两种由X、Y和氢三种元素形成的不同类别的化合物的化学式:HNO3、NH3•H2O (每个类别任写一种)
(4)Z元素的单质与水反应的化学方程式2F2+2H2O=4HF+O2
(5)W、T的最高价氧化物对应的水化物酸性较弱的是H2GeO3.
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y、Z处于第二周期,W处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为F、T为Ge,据此解答.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y、Z处于第二周期,W处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为F、T为Ge,
(1)X元素是氮元素,单质分子结构式:N≡N,故答案为:N≡N;
(2)X、Y、Z三种元素最低价氢化物分别为氨气、水、HF,常温下水为液态,氨气、HF为气体,故水的沸点最高,故答案为:H2O;
(3)X为N、Y为O、和氢三种元素形成的不同类别的化合物的化学式:酸是HNO3、碱是NH3•H2O、盐是NH4NO3,故答案为:HNO3;NH3•H2O;
(4)Z元素的单质是氟气,氟气与水反应生成氢氟酸和氧气,化学方程式为:2F2+2H2O=4HF+O2,故答案为:2F2+2H2O=4HF+O2;
(5)元素非金属性越强最高价氧化物对应水化物的酸性越强,而同主族元素从上到下非金属性减弱,所以Ge最高价氧化物对应水化物的酸性强,其化学式为:H2GeO3,故答案为:H2GeO3.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意A中氢键对物质性质的影响,难度中等.

练习册系列答案
相关题目
19.已知R2+核内有x个中子,R原子的质量数为m,则ngR2+所含电子的总物质的量是( )
| A. | $\frac{n(m-x+2)}{m}$ mol | B. | $\frac{n(m-x)}{m}$ mol | C. | $\frac{m-x+2}{m-n}$ mol | D. | $\frac{n(m-x-2)}{m}$ mol |
5.下列物质不能和溴水发生化学反应而能使酸性高锰酸钾退褪色是( )
| A. | C2H5OH | B. | 苯酚 | C. | 甲苯 | D. | 乙醛 |
2.一定温度下,对于已达到平衡的可逆反应:FeCl3+3KSCN?3KCl+Fe(SCN)3,在此溶液中作如下处理,化学平衡逆向移动的是( )
| A. | 加入少量的KCl固体 | B. | 加入少量FeCl3固体 | ||
| C. | 降低Fe(SCN)3的浓度 | D. | 加水稀释 |
6.下列各组微粒中,电子层数和最外层电子数都相同的是( )
| A. | F-和Mg2+ | B. | S和S2- | C. | Al3+和Ar | D. | He和H+ |
3.反应4A(g)?2B(g)+E(g)△H>0.达到平衡时,欲使正反应速率降低,A的浓度增大,应采取的措施是( )
| A. | 加压 | B. | 减压 | C. | 升温 | D. | 减少E的浓度 |
 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)
碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g)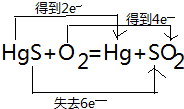 ,氧化剂是HgS、O2,还原产物:Hg、SO2.
,氧化剂是HgS、O2,还原产物:Hg、SO2.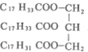 .请回答下列问题:
.请回答下列问题: (写结构简式).
(写结构简式). .
.