题目内容
某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1∶3,则与溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
| A.21∶5 | B.11∶3 | C.4∶1 | D.3∶1 |
C
解析试题分析:根据电子得失守恒,假设ClO-为1mol,ClO3-为3mol,共失去电子为1+3×5=16mol;故被氧化的为1+3=4mol,被还原的为16mol,故答案选C。
考点:氧化还原反应的规律。

将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、NO2)的混合物共0.8 mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH=NaNO2+NaNO3+H2O、NO+NO2+2NaOH=2NaNO2+H2O。则生成的盐溶液中NaNO3的物质的量为
| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
在实验室中,常用KMnO4代替MnO2与浓盐酸反应制取氯气,其反应的化学方程式为
2KMnO4+16HCl(浓)= 2MnCl2+5Cl2↑+2KCl+8H2O,下列叙述中正确的是( )
| A.反应中KMnO4被氧化 |
| B.氧化产物与还原产物的物质的量之比为2﹕5 |
| C.每生成1 mol Cl2时,反应中转移的电子为2 mol |
| D.每消耗16 mol HCl时,其中做氧化剂的HCl是10 mol |
a mol FeS与b mol FeO投入到VL、c mol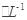 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)x63g ②(a+b)x189g ③(a+b)mol ④(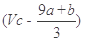 )mol
)mol
| A.①④ | B.②③ | C.①③ | D.②④ |
在反应KClO3+6HCl=KCl+3Cl2+3H2O中,被还原和被氧化的氯原子的质量比为
| A.1 :6 | B.6 :1 | C.1 :5 | D.5 :1 |
氧化还原反应实际上包含氧化和还原两个过程。(1)向氯酸钠的酸性水溶液中通入二氧化硫,该反应中氧化过程的反应式为:SO2+2H2O – 2e-→ SO42- + 4H+; (2)向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯 气,该反应中还原过程的反应式为:Cl2 + 2e-→ 2Cl-。在(1)和(2)反应中均会生成产物X,则X的化学式为( )
| A.NaClO | B.NaClO4 | C.HClO | D.ClO2 |
臭氧可使湿润的淀粉KI试纸变蓝,化学方程式为2KI+O3+H2O=2KOH+I2+O2。下列叙述中正确的是( )
| A.在反应中水被氧化成氧气 | B.该反应中水是氧化剂 |
| C.每生成1 mol I2,转移的电子数为1 mol | D.反应中氧化剂与还原剂的物质的量之比为1∶2 |
氮化铝(AlN)广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可在一定条件下合成:Al2O3 + N2 + 3C → 2AlN + 3CO。下列叙述正确的是( )
| A.上述反应中, N2是还原剂,Al2O3是氧化剂; |
| B.上述反应中,每生成 1mol AlN需转移3mol 电子 |
| C.AlN中氮元素的化合价为+3 |
| D.AlN的摩尔质量为41g |
汽车安全气囊是汽车安全性辅助配置之一。汽车剧烈碰撞时,安全气囊中发生反应:10NaN3 +2KNO3 ==K2O+5Na2O+16N2↑,则下列判断不正确的是
| A.NaN3是还原剂 |
| B.N2既是氧化产物又是还原产物 |
| C.氧化产物与还原产物物质的量之比为1:15 |
| D.标准状况下,当有10mol电子转移时生成358.4L N2 |