题目内容
【题目】三氯异氰尿酸是一种极强的氧化剂和氯化剂,利用氰尿酸(图1)与次氯酸在一定pH下反应可制备三氯异氰尿酸(图2),若原料完全反应生成三氯异氰尿酸,下列说法正确的是
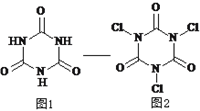
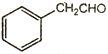
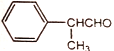
A. 氰尿酸的分子式为C6N3O3H3
B. HClO的电子式为 ![]()
C. 该转化过程有机物发生还原反应
D. 氰尿酸和次氯酸反应的物质的量之比为2 : 3
【答案】B
【解析】分析:A、根据结构简式判断分子式;
B、次氯酸是共价化合物,据此书写电子式;
C、根据氢原子被氯原子代替分析;
D、根据原子守恒解答。
详解:A、根据氰尿酸的结构简式可知其分子式为C3N3O3H3,A错误;
B、HClO分子中含有共价键,其电子式为![]() ,B正确;
,B正确;
C、该转化过程中氢原子被氯原子取代,有机物发生取代反应,C错误;
D、根据原子守恒可知氰尿酸和次氯酸反应的物质的量之比为1:3,D错误。答案选B。

 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】碳是自然界中形成化合物种类最多的元素,CO和CO2是碳的最常见氧化物。
(1)研究和解决二氧化碳捕集和转化问题是当前科学研究的前沿领域。在太阳能的作用下,缺铁氧化物[Fe0.9O]能分解CO2,其过程如图1所示。过程①的化学方程式是______。在过程②中每产生0.1molO2,转移电子______mol。

(2)在催化剂作用下,将二氧化碳和氢气混合反应生成甲烷,是目前科学家们正在探索的处理空气中的二氧化碳的方法之一。
①已知:
共价键 | C=O | H—H | C—H | O—H |
键能/(kJmol-1) | 745 | 436 | 413 | 463 |
则CO2(g)+4H2(g)![]() CH4(g)+2H2O(g) △H=______kJmol-1。
CH4(g)+2H2O(g) △H=______kJmol-1。
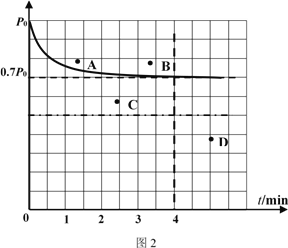
②向1L固定容积的密闭容器中加入4.0 mol H2(g)、1.0mol CO2,控制条件(催化剂:铑—镁合金、高温T1)使之反应,若测得容器内气体的压强随着时间的变化如图2所示。则4 min时容器内气体的密度为______;温度T1 下,该反应的化学平衡常为______。若采用2 L固定容积的密闭容器,投料量、催化剂和反应温度均保持不变,则反应重新达到平衡时对应体系内的压强的点是______(填字母)。
(3)工业合成原料气CO会与设备、管道及催化剂表面的金属铁、镍反应,生成羰基化合物。四羰基镍是热分解法制备高纯镍的原料,也是有机合成中供给一氧化碳的原料,还可做催化剂。Ni(s)+4CO(g)![]() Ni(CO)4(g) △H<0 Ni(CO)4(g)
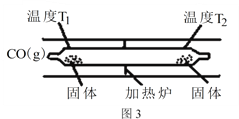
Ni(CO)4(g) △H<0 Ni(CO)4(g)![]() Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。
Ni(s)+4CO(g)。如图3所示,在石英真空管的温度为T1一端,放入少量粗镍和CO(g),一段时间后,在温度为T2的一端可得到纯净的镍。则温度T1______T2(填“>”“<”或“=”),上述反应体系中循环使用的物质为______(填化学式)。