题目内容
20.现有下列物贡:①甲烷 ②乙烯 ③苯 ④乙醇 ⑤乙酸 ⑥CH3CH2CH2CH3 ⑦(CH3)2CHCH2CH3(1)碳原子间的成键方式完全相同的是⑥⑦.
(2)碳原子周围有双键的是②⑤.
(3)碳原子周围有三种共价键的是④⑤.
分析 (1)①⑥⑦中C均为sp3杂化,②中C为sp2杂化,③中含大π键,④中含C-O键,⑤中含C=O、C-O键;
(2)烯烃、乙酸中碳原子周围有双键;
(3)甲烷中只含C-H键,②③⑥⑦中均含C、H之间的共价键和C、C之间的共价键,乙酸中含C-C、C=O、C-O、O-H、C-H共价键,乙醇中含C-C、C-O、O-H、C-H共价键.
解答 解:(1)①⑥⑦中C均为sp3杂化,②中C为sp2杂化,③中含大π键,④中含C-O键,⑤中含C=O、C-O键,则碳原子间的成键方式完全相同的是⑥⑦,均含C-C、C-H,故答案为:⑥⑦;
(2)①③④⑥⑦中不含双键,烯烃、乙酸中碳原子周围有双键,故答案为:②⑤;
(3)甲烷中只含C-H键,②③⑥⑦中均含C、H之间的共价键和C、C之间的共价键,乙酸中含C-C、C=O、C-O、O-H、C-H共价键,乙醇中含C-C、C-O、O-H、C-H共价键,则碳原子周围有三种共价键的是④⑤,故答案为:④⑤.
点评 本题考查化学键,为高频考点,把握化学键的判断为解答的关键,侧重分析与应用能力的考查,常见有机物中的化学键,题目难度不大.

练习册系列答案
相关题目
10.下列说法错误的是( )
| A. | FeO是碱性氧化物 | |
| B. | 用加热法分离泥沙中的碘单质是化学变化 | |
| C. | 丁达尔效应可用于区分胶体和溶液 | |
| D. | Fe2O3+3CO $\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3CO2 是复分解反应 |
15.下列物质的属类归纳中不正确的是( )
| A. | 蔗糖、酒精、甲烷等含碳化合物称为有机物 | |
| B. | 由金属离子和酸根离子组成的化合物称为盐 | |
| C. | 在水溶液中电离出的阳离子全部为氢离子的化合物 | |
| D. | 含氧元素的化合物称为氧化物 |
12. 已知NaAlO2溶液与NaHCO3溶液发生反应:AlO${\;}_{2}^{-}$+HCO${\;}_{3}^{-}$+H2O═Al(OH)3↓+CO${\;}_{3}^{2-}$.现向1L含KOH、Ba(OH)2、KAlO2的溶液中不断通入CO2气体,随着CO2的不断通入,溶液中离子的数目也相应地发生变化(如图所示).图中的a、b、c、d、e五条曲线与溶液中离子的对应关系完全正确的是( )
已知NaAlO2溶液与NaHCO3溶液发生反应:AlO${\;}_{2}^{-}$+HCO${\;}_{3}^{-}$+H2O═Al(OH)3↓+CO${\;}_{3}^{2-}$.现向1L含KOH、Ba(OH)2、KAlO2的溶液中不断通入CO2气体,随着CO2的不断通入,溶液中离子的数目也相应地发生变化(如图所示).图中的a、b、c、d、e五条曲线与溶液中离子的对应关系完全正确的是( )
 已知NaAlO2溶液与NaHCO3溶液发生反应:AlO${\;}_{2}^{-}$+HCO${\;}_{3}^{-}$+H2O═Al(OH)3↓+CO${\;}_{3}^{2-}$.现向1L含KOH、Ba(OH)2、KAlO2的溶液中不断通入CO2气体,随着CO2的不断通入,溶液中离子的数目也相应地发生变化(如图所示).图中的a、b、c、d、e五条曲线与溶液中离子的对应关系完全正确的是( )
已知NaAlO2溶液与NaHCO3溶液发生反应:AlO${\;}_{2}^{-}$+HCO${\;}_{3}^{-}$+H2O═Al(OH)3↓+CO${\;}_{3}^{2-}$.现向1L含KOH、Ba(OH)2、KAlO2的溶液中不断通入CO2气体,随着CO2的不断通入,溶液中离子的数目也相应地发生变化(如图所示).图中的a、b、c、d、e五条曲线与溶液中离子的对应关系完全正确的是( ) | 选项 | a | b | c | d | e |
| A | Ba2+ | OH- | HCO${\;}_{3}^{-}$ | AlO${\;}_{2}^{-}$ | Ba2+ |
| B | OH- | Ba2+ | AlO${\;}_{2}^{-}$ | Ba2+ | HCO${\;}_{3}^{-}$ |
| C | Ba2+ | OH- | AlO${\;}_{2}^{-}$ | HCO${\;}_{3}^{-}$ | Ba2+ |
| D | Ba2+ | OH- | AlO${\;}_{2}^{-}$ | CO${\;}_{3}^{2-}$ | HCO${\;}_{3}^{-}$ |
| A. | A | B. | B | C. | C | D. | D |
17.有一种塑料袋的主要成分是高分子化合物──聚氯乙烯.下列有关聚氯乙烯的说法中正确的是( )
| A. | 聚氯乙烯是纯净物 | |
| B. | 合成聚氯乙烯的单体是CH2=CH-Cl | |
| C. | 聚氯乙烯的长链上含有碳碳双键 | |
| D. | 聚氯乙烯分子中的化学键在自然界中容易断裂 |

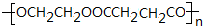 +2nH2O.
+2nH2O.
 Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Ⅰ.Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.