题目内容
现有常温下的四份溶液:①pH=2的CH3COOH溶液;②pH=2的稀HCl;③0.01mol/L氨水;
④0.01mol/L NaOH溶液。下列说法正确的是
④0.01mol/L NaOH溶液。下列说法正确的是
| A.将四份溶液稀释相同倍数后,溶液的pH:③<④,②<① |
| B.若将②、③等体积混合,则混合液的PH为7 |
| C.四份溶液中水的电离程度由大到小的顺序为:③>①=②=④ |
| D.若在10mL①中加入④至PH刚好等于7,则C(Na+)= C(CHCOO-),混合溶液总体积< 20mL(假设混和溶液体积为酸和碱溶液体积之和) |
A
试题分析:醋酸和氨水都是弱电解质,盐酸和氢氧化钠都是强电解质。由于稀释促进弱电解质的电离,所以将四份溶液稀释相同倍数后,溶液的pH:③<④,②<①,A正确;若将②、③等体积混合,酸碱恰好中和,生成的氯化铵水解,则混合液的PH小于7,B不正确;酸碱溶液中氢离子浓度或OH-浓度越大,对水的电离抑制程度越大,所以四份溶液中水的电离程度由大到小的顺序为:③<①=②=④,C不正确;醋酸的浓度大于0.01mol/L,则D中如果氢氧化钠溶液的体积10mol,则反应后醋酸过量,溶液显酸性。所以要使溶液要显中性,则氢氧化钠溶液的体积必然大于10mol,则混合溶液总体积大于20mL,D不正确,答案选A。
点评:该题设计新颖,基础性强。注重答题的灵活性。该题的关键是明确弱电解质的电离平衡特点以及外界条件对弱电解质电离平衡的影响,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。另外还需要特别注意的是,酸碱中和时溶液酸碱性的判断,要首先判断溶液的过量问题,只有当恰好反应时,才能考虑生成的盐是否水解。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
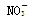
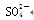
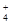 、Cl- 、NO
、Cl- 、NO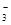
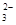 、Na+、S2-
、Na+、S2-