题目内容
【题目】实验室常见的仪器如下图所示,请回答下列问题:
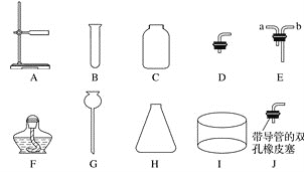
(1)仪器Ⅰ的名称为__________;仪器G的名称为__________。
(2)若将B、D、F组合成气体发生装置,则该制气原理的反应条件一定是__________________。
(3)若将C、G、H、I、J(导管略)组合成一套制取并收集气体的装置,则该装置收集得到的常见气体可能是____________。
(4)若将C、E装置组合用于向上排空气法收集气体,则气体从________(填“a”或“b”)导管口进入。
【答案】水槽 长颈漏斗 加热 氧气、氢气 b
【解析】
(1)根据仪器构造判断其名称;
(2)发生装置的选择与反应物的状态和反应条件有关,根据选择的装置进行解答;
(3)根据选择的装置特点推测气体的性质;
(4)密度大于空气且与空气不反应的气体可以用向上排空气法收集,据此判断。
(1)仪器Ⅰ的名称为水槽;仪器G的名称为长颈漏斗。
(2)如果将B、D、F组合成气体发生装置,由于装置F是酒精灯,则该制气原理的反应条件一定是加热。
(3)如果将C、G、H、I、J组合成一套制取并收集气体的装置,由于含有水槽,可推测能用排水法收集的气体,则该装置收集得到的常见气体可能是氧气、氢气;
(4)如果将C、E装置组合用于向上排空气法收集气体,收集比空气重的气体,故气体从b进入。

【题目】 已知常温下部分弱电解质的电离平衡常数如下表:
化学式 | HF | HClO | H2CO3 | NH3·H2O |
电离常数 | 6.8×104 | 4.7×108 | K1=4.3×107 K2=5.6×1011 | Kb=1.7×105 |
(1)常温下,PH相同的三种溶液①NaF溶液 ②NaClO溶液 ③Na2CO3溶液,其物质的量溶度由大到小的顺序是___________(填序号)
(2)25°C时,PH=4的NH4Cl溶液中各离子浓度的大小关系为___________________
(3)0.1 mol/L的NaClO溶液和0.1 mol/L的NaHCO3溶液中,c(ClO-)________ c(HCO3-)(填“>,<,=”)可使上述两种溶液PH相等的方法是___________(填代号)
a.向NaClO溶液中加适量的水 b.向NaClO溶液中加适量的NaOH
c.向NaHCO3溶液中加适量的水 d. 向NaHCO3溶液中加适量的NaOH
(4)向NaClO溶液中通入少量的CO2,所发生的离子方程式为_________
(5)常温下,0.1mol/L的氨水和0.1mol/L的NH4Cl溶液等体积混合,判断混合溶液的酸碱性____________(填“酸性”“碱性”“中性”)

