题目内容
(1)已知某反应的各物质浓度数据如下:aA(g)+bB(g) 2C(g)
2C(g)起始浓度(mol/L):1.5 1.0 0
2s末浓度(mol/L):0.9 0.8 0.4
则①a=______,b______.
②2S内B的反应速率=______.
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电______池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有______个电子通过了电线?(NA=6.02×1023)
④此时溶液中H+的物质的量浓度为______(不考虑溶液体积变化).
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是______(用含m的代数式表示)
【答案】分析:(1)①先求出A、B的浓度变化量,浓度变化量之比等于化学计量数之比,由此确定a、b的值;
②利用v=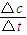 计算v(B);
计算v(B);
(2)③氧化还原反应中电子转移数目即为电线中通过的电子;
④根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度;
(3)利用Na原子守恒,求出NaOD的质量,溶液的质量=钠的质量+重水的质量-生成的氢气的质量,再利用质量分数定义计算.
解答:(1)①由题目数据可知,A的浓度变化量为1.5mol/L-0.9mol/L=0.6mol/L,B的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,C的浓度变化量为0.4mol/L.
浓度变化量之比等于化学计量数之比,所以a:b:2=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以a=3,b=1.
故答案为:a=3 b=1
②2S内B的反应速率v(B)=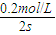 =0.1mol/(L?S)
=0.1mol/(L?S)
故答案为:0.1mol/(L?S)
(2)③碳棒上产生气体3.36L为氢气,反应转移的电子的物质的量为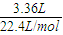 ×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.
×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.
故答案为:1.806×1023
④根据H原子守恒可知,参加反应H+的物质的量为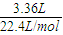 ×2=0.3mol,H+的物质的量浓度变化量△c(H+)=
×2=0.3mol,H+的物质的量浓度变化量△c(H+)=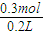 =1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.
=1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.
故答案为:1.5mol/L
(3)n(Na)=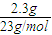 =0.1mol
=0.1mol
根据Na原子守恒n(NaOD)=n(Na)=0.1mol,所以m(NaOD)=0.1mol×41g/mol=4.1g;
根据转移电子守恒n(D2)= n(Na)=
n(Na)= ×0.1mol=0.05mol,所以m(D2)=0.05mol×4g/mol=0.2g;
×0.1mol=0.05mol,所以m(D2)=0.05mol×4g/mol=0.2g;
溶液中溶质的质量分数为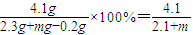 ×100%
×100%
故答案为: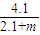 ×100%
×100%
点评:考查化学平衡及反应速率计算、原电池、溶液计算,综合较大,难度较小,(3)中溶液质量的确定为易错点,容易忽略生成的D2,容易把D2O按H2O计算.
②利用v=
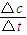 计算v(B);
计算v(B);(2)③氧化还原反应中电子转移数目即为电线中通过的电子;
④根据生成的氢气计算出参加反应的H+的物质的量,计算出溶液中H+的物质的量浓度变化量,原稀硫酸溶液中H+的物质的量浓度减去溶液中H+的物质的量浓度变化量,即为所求溶液中H+的物质的量浓度;
(3)利用Na原子守恒,求出NaOD的质量,溶液的质量=钠的质量+重水的质量-生成的氢气的质量,再利用质量分数定义计算.
解答:(1)①由题目数据可知,A的浓度变化量为1.5mol/L-0.9mol/L=0.6mol/L,B的浓度变化量为1.0mol/L-0.8mol/L=0.2mol/L,C的浓度变化量为0.4mol/L.
浓度变化量之比等于化学计量数之比,所以a:b:2=0.6mol/L:0.2mol/L:0.4mol/L=3:1:2,所以a=3,b=1.
故答案为:a=3 b=1
②2S内B的反应速率v(B)=
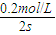 =0.1mol/(L?S)
=0.1mol/(L?S)故答案为:0.1mol/(L?S)
(2)③碳棒上产生气体3.36L为氢气,反应转移的电子的物质的量为
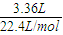 ×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.
×2=0.3mol,所以电线中通过的电子数目为0.3mol×6.02×1023mol-1=1.806×1023.故答案为:1.806×1023
④根据H原子守恒可知,参加反应H+的物质的量为
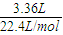 ×2=0.3mol,H+的物质的量浓度变化量△c(H+)=
×2=0.3mol,H+的物质的量浓度变化量△c(H+)=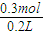 =1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.
=1.5mol/L,所以液中H+的物质的量浓度c(H+)=1.5mol/L×2-1.5mol/L=1.5mol/L.故答案为:1.5mol/L
(3)n(Na)=
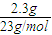 =0.1mol
=0.1mol根据Na原子守恒n(NaOD)=n(Na)=0.1mol,所以m(NaOD)=0.1mol×41g/mol=4.1g;
根据转移电子守恒n(D2)=
 n(Na)=
n(Na)= ×0.1mol=0.05mol,所以m(D2)=0.05mol×4g/mol=0.2g;
×0.1mol=0.05mol,所以m(D2)=0.05mol×4g/mol=0.2g;溶液中溶质的质量分数为
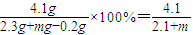 ×100%
×100% 故答案为:
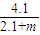 ×100%
×100%点评:考查化学平衡及反应速率计算、原电池、溶液计算,综合较大,难度较小,(3)中溶液质量的确定为易错点,容易忽略生成的D2,容易把D2O按H2O计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
已知某反应的各物质浓度数据如下:aA(g)+bB(g)?cC(g)
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
由此可推出方程式中各物质的化学计量数(系数)之比为( )
起始浓度(mol/L) 3.0 1.0 0
2s末浓度(mol/L) 1.8 0.6 0.8
由此可推出方程式中各物质的化学计量数(系数)之比为( )
| A、3:1:2 | B、2:1:3 | C、9:3:4 | D、3:2:1 |
 2C(g)
2C(g)

 2C(g)
2C(g) +Br2→
+Br2→
 +HO-NO2
+HO-NO2 +H2O
+H2O