题目内容
5.已知16S和34Se位于同一主族,下列说法正确的是( )| A. | 热稳定性:H2Se>H2S>H2O | B. | 原子半径:Se>S>Cl | ||
| C. | 酸性:H2SeO4>H2SO4>HClO4 | D. | 还原性:S2->Se2->Br- |
分析 A.元素非金属性越强,其氢化物的稳定性越强;
B.电子层数越多原子半径越大,同一周期元素原子半径随着原子序数增大而减小;
C.元素非金属性越强,其最高价氧化物的水化物酸性越强;
D.元素非金属性越强,其简单阴离子还原性越弱.
解答 解:A.元素非金属性越强,其氢化物的稳定性越强,非金属性O>S>Se,所以氢化物的稳定性H2Se<H2S<H2O,故A错误;
B.电子层数越多原子半径越大,同一周期元素原子半径随着原子序数增大而减小,Se有四个电子层、S和Cl有三个电子层,且S原子序数小于Cl,所以原子半径Se>S>Cl,故B正确;
C.元素非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Cl>S>Se,所以最高价氧化物的水化物酸性H2SeO4<H2SO4<HClO4,故C错误;
D.元素非金属性越强,其简单阴离子还原性越弱,非金属性Br>S>Se,所以还原性:Se2->S2->Br-,故D错误;
故选B.
点评 本题考查同一周期同一主族元素性质递变规律,为高频考点,明确元素周期律内涵是解本题关键,知道非金属性强弱判断方法,题目难度不大.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目
15.柑橘中柠檬烯的结构可表示为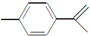 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )
 ,下列关于这种物质的说法中不正确的是( )
,下列关于这种物质的说法中不正确的是( )| A. | 该物质难溶于水 | |
| B. | 分子式为C10H14 | |
| C. | 既能发生取代反应,又能发生加成反应 | |
| D. | 既能使酸性高锰酸钾褪色又能使溴的四氯化碳溶液褪色 |
16.下列变化过程中破坏化学键的是( )
| A. | 水加热汽化 | B. | 熔融氯化钠 | C. | 乙醇溶于水 | D. | 粉碎金刚石 |
13.下列措施对加快反应速率有明显效果的是( )
| A. | Na与水反应时.增加水的用量 | |
| B. | Al与稀硫酸反应制取H2时.改用浓硫酸 | |
| C. | Na2SO4与BaCl2两种溶液反应时.增大压强 | |
| D. | 大理石和盐酸反应制取C02时.将块状大理石改为粉末状 |
20.如图表示物质通过一步反应的转化关系,下列说法正确的是( )
X$\stackrel{O_{2}}{→}$酸性氧化物→酸.
X$\stackrel{O_{2}}{→}$酸性氧化物→酸.
| A. | X可能是Al单质 | B. | X可能是H2 | ||
| C. | 酸可能为H2SO4 | D. | 酸性氧化物可能为SiO2 |
17.下列各组中的反应,属于同一反应类型的是( )
| A. | 由2-溴丙烷制2-丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯制对硝基甲苯;由甲苯制苯甲酸 | |
| C. | 由氯代环己烷制环己烯;由丙烯与溴水反应制1,2-二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由苯甲酸乙酯与水反应制苯甲酸和乙醇 |
14.汽车尾气中的二氧化氮在低层大气中可形成化学烟雾,并循环生成臭氧,反应机理为:( )
①NO2$\frac{\underline{\;he\;}}{\;}$NO+O;②O+O2═O;③-----.该过程的总反应为3O2═2O3.则下列说法正确的是.
①NO2$\frac{\underline{\;he\;}}{\;}$NO+O;②O+O2═O;③-----.该过程的总反应为3O2═2O3.则下列说法正确的是.
| A. | 反应③为N2O4═2NO2 | |
| B. | 该过程最终会导致大气中O的含量增加 | |
| C. | 总反应中NO2作催化剂 | |
| D. | 该反应可用于修复大气“臭氧空调” |
15.20世纪80年代后,人们发现和证实了碳的另一类单质,它们是由一系列偶数个碳原子组成的分子,其中C60(足球烯,分子中含有30个双键)最具代表性.X为n个C60连接而成的物质,结构如图:
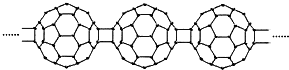
下列有关说法正确的是( )

下列有关说法正确的是( )
| A. | C60转变为X是物理变化 | B. | X中含有极性共价键 | ||
| C. | X与金刚石互为同素异形体 | D. | X能够发生加成反应 |
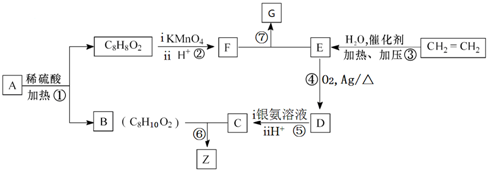
 2CH3CHO+2H2O,在①~⑦的反应中,属于取代反应的有①⑥⑦.
2CH3CHO+2H2O,在①~⑦的反应中,属于取代反应的有①⑥⑦.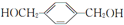 ,其所含官能团名称为羟基.
,其所含官能团名称为羟基. .
.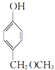 ,
,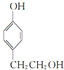 ,
,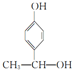 ,
,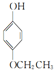 ,.
,.