题目内容
【题目】某温度时,AgCl(s)![]() Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的溶解平衡曲线如图。下列说法正确的是
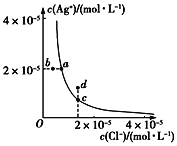
A. 加入AgNO3可以使溶液由c点变到d点
B. 加入固体NaCl,则AgCl的溶解度减小,Ksp也减小
C. d点有AgCl沉淀生成
D. a点对应的Ksp小于b点对应的Ksp
【答案】C
【解析】
A. 加入AgNO3可以使银离子浓度增大,AgCl(s)![]() Ag+(aq)+Cl-(aq)平衡逆向移动,氯离子浓度减小,而c、d点氯离子浓度相同,故A错误;
Ag+(aq)+Cl-(aq)平衡逆向移动,氯离子浓度减小,而c、d点氯离子浓度相同,故A错误;
B. 加入NaCl固体,氯离子浓度增大,AgCl(s)![]() Ag+(aq)+Cl-(aq)平衡逆向移动,银离子浓度减小,则AgCl的溶解度减小,但Ksp只随温度变化,温度不变,Ksp不变,故B错误;
Ag+(aq)+Cl-(aq)平衡逆向移动,银离子浓度减小,则AgCl的溶解度减小,但Ksp只随温度变化,温度不变,Ksp不变,故B错误;
C. d点处银离子浓度大,此时银离子浓度和氯离子浓度乘积大于溶度积常数,有氯化银沉淀生成,故C正确;
D. 温度不变Ksp不变,a、c点是相同温度下的沉淀溶解平衡,Ksp相同,故D错误,答案选C。

 阅读快车系列答案
阅读快车系列答案【题目】合成氨是人类研究的重要课题,目前工业合成氨的原理为:N2(g) + 3H2(g) ![]() 2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下:
时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)=____________。
②平衡时,H2的转化率为______;
该温度下,反应2NH3(g)![]() N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
N2(g) + 3H2(g) 的平衡常数K=_______ (mol/L)2。
③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3的浓度与上表中相同的为_______(填选项字母)。
A.a=l、b=3、c=0 B.a=4、b=12、c=0
C.a=0、b=0、c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286.0kJ/mol,则用N2与水反应制NH3的热化学方程式为________________________________。