题目内容
(8分) 将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。

(1)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(2)滴入的NaOH溶液_____mL 时,溶液中的Mg2+和Al3+刚好沉淀完全。
(3)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________

(1)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(2)滴入的NaOH溶液_____mL 时,溶液中的Mg2+和Al3+刚好沉淀完全。
(3)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
(8分) (1)0.04 460 (2)400 (3)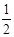 ≤a<1
≤a<1
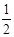 ≤a<1
≤a<1试题分析:(1)设混合物蒸干镁和铝的物质的量分别是x和y,则x+y=0.1mol,消耗盐酸分别是x和1.5y。根据图像可知,和氢氧化钠反应的盐酸的物质的量是0.14L×1mol/L=0.14,则和金属反应的盐酸是0.4mol-0.14mol=0.26mol,即x+1.5y=0.26mol,解得x=0.04mol,y=0.06mol,所以生成的氢氧化铝是0.06mol,而溶解氢氧化铝消耗的氢氧化钠是0.06mol,因此V2对应的氢氧化钠的物质的量是0.4mol+0.06mol=0.46mol,则V2=460ml。
(2)根据方程式Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓可知,需要氢氧化钠的物质的量是0.08mol+0.18mol=0.26mol,所以溶液中的Mg2+和Al3+刚好沉淀完全时需要氢氧化钠的物质的量是0.26mol+0.14mol=0.4mol,体积是400ml。
(3)混合物中Mg的物质的量分数为a,则镁的物质的量是0.1amol,铝的物质的量是(0.1-0.1a)mol,所以根据方程式可知,当沉淀最大时消耗氢氧化钠是0.4mol,当所得沉淀中无Al(OH)3,一定有0.1-0.1a≤0.45-0.4,解得1/2≤a<1。
点评:根据方程式进行的有关计算,关键是准确写出反应的化学方程式,然后逐一进行分析并解答,同时结合各种守恒法。

练习册系列答案
相关题目