题目内容
下列各组微粒中,属于同位素的是
A.O2、O3 B.Na2O、Na2O2 C.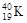 、
、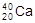 D.H、D、T
D.H、D、T
D
解析试题分析:同位素是相对于核素来说的。同位素是指具有相同的质子数,不同的中子数,所以答案选D
考点:考查同位素的相关知识点

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知下列元素的原子半径:
| 元素 | N | S | O | Si |
| 原子半径/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
A.0.80×10-10 m B.1.10×10-10 m C.1.20×10-10 m D.0.70×10-10 m
能说明M的非金属性比N强的事实是
| A.M的气态氢化物比N的气态氢化物稳定 |
| B.HxM的酸性比HyN的酸性强 |
| C.单质M的熔沸点比单质N的溶沸点高 |
| D.M能将N从它的盐溶液中置换出来 |
对元素周期表和元素周期律的发现有突出贡献的科学家是
| A.拉瓦锡 | B.门捷列夫 | C.阿伏加德罗 | D.道尔顿 |
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13,X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍,下列说法正确的是
| A.X的氢化物溶于水生成弱酸 | B.Z的氢化物的水溶液在空气中存放不易变质 |
| C.Y与X可生成Y3X2型化合物 | D.Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
我国最新报导的高超导体中,铊(Tl)是其中之一,已知位于第六周期第ⅢA族,关于铊的说法,可能错误的是 ( )
| A.是银白色金属 | B.Tl(OH)3 有两性 |
| C.与稀盐酸反应生成盐酸盐 | D.铊的金属性强于铝的金属性 |
已知X、Y是主族元素,I为电离能,单位kJ/mol。根据下表所列数据判断错误的是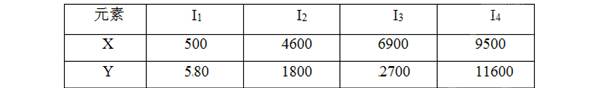
| A.元素X的常见化合物价是+1价 |
| B.若元素Y处于第3周期,它可与冷水剧烈反应 |
| C.元素X与氯形成化合物时,化学式可能是XCl |
| D.元素Y是ⅢA族的元素 |
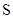
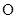
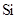
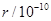 m
m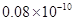 m B.
m B.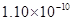 m C.
m C. m D.
m D.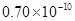 m
m