题目内容
【题目】“84消毒液”是一种以NaClO为主的高效消毒剂,被广泛用于宾馆、旅游、医院、食品加工行业、家庭等的卫生消毒。某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用。请回答下列问题:


(1)此“84消毒液”的物质的量浓度约为________。(计算结果保留一位小数)
(2)某同学量取100mL此“84消毒液”,按说明要求稀释后用于消毒,则稀释后的溶液中c(Na+)=___mol/L。
(3)该同学参阅读该“84消毒液”的配方,欲用NaClO固体配制480 mL含NaClO质量分数为24%的消毒液。
①如图所示的仪器中配制溶液需要使用的是________________(填仪器序号),还缺少的玻璃仪器是______________。
②该同学配制此溶液需称取称量NaClO固体的质量为_________________g。
(4)若实验遇下列情况,导致所配溶液的物质的量浓度偏高的是____________(填序号)。
a.定容时俯视刻度线 b.转移前,容量瓶内有蒸馏水
c.未冷至室温就转移定容 d.定容时水多加了,用胶头滴管吸出
【答案】3.8 mol/L 0.038 CDE 玻璃棒和胶头滴管 141.6 AC
【解析】
(1)根据含24%NaClO、1000mL、密度1.18g·cm-3,结合c=1000ρω/M来计算;
(2)根据稀释前后溶质的物质的量不变来计算;
(3)①根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶来分析所需的仪器;
②由于实验室无480mL容量瓶,故应选用500mL容量瓶,根据所需的质量m=cVM来计算;
(4)分析具体操作对n、V的影响,根据c=n/V分析不当操作对溶液浓度的影响。
(1)c(NaClO)=1000ρω/M=1000×1.18×24%/74.5 mol·L-1=3.8 mol·L-1;
(2)稀释后c(NaClO)=3.8 mol·L-1÷100=0.038 mol·L-1,c(Na+)=c(NaClO)=0.038mol·L-1;
(3)①由于实验室无480mL容量瓶,故应选用500mL容量瓶,根据配制一定物质的量浓度的溶液的步骤是计算、称量、溶解、冷却、移液、洗涤、定容、摇匀和装瓶可知所需的仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶和胶头滴管,故需要的是CDE,还需要的是玻璃棒、胶头滴管;
②质量分数为24%的消毒液的浓度为3.8mol·L-1,由于实验室无480mL容量瓶,故应选用500mL容量瓶,故所需的质量m=cVM=3.8mol·L-1×0.5L×74.5g·mol-1=141.6g;
(4)A.定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故A正确;
B.转移前,容量瓶内有蒸馏水,对溶液浓度无影响,故B错误;
C.未冷至室温就转移定容,则冷却后溶液体积偏小,则浓度偏高,故C正确;
D.定容时水多用胶头滴管吸出,则吸出的不只是溶剂,还有溶质,故溶液浓度偏小,故D错误。
故选AC。

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案【题目】Ⅰ.下图是元素周期表的一部分,根据①~⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素①~⑧中,除⑧外,原子半径最大的是___________(填元素符号),元素③、⑦所形成的氢化物的稳定性由强到弱的顺序为__________________(用相应氢化物的化学式作答)元素②的氢化物的电子式是____________。
(2)④⑤⑥三种元素的氢氧化物的碱性由强到弱的顺序是________(用相应氢氧化物的化学式作答),元素①~⑧中的最高价氧化物对应的水化物中酸性最强的酸是_______(填化学式)。
Ⅱ.实验室用密度为1.84g/cm3,溶质的质量分数为98%的硫酸,配制980mL物质的量浓度为0.1mol/L的硫酸。供选用的仪器有:①胶头滴管;②药匙;③烧杯;④量筒;⑤托盘天平。请回答下列问题:
(1)配制上述溶液量取浓硫酸时应选用__________量筒(选填序号)
①10mL ②50mL ③100mL;
(2)配制稀硫酸时,上述仪器中还缺少的仪器有____________________________(写仪器名称),不需要使用的有______________(选填序号);
(3)下列操作使所配溶液的物质的量浓度偏低的是___________。
A.用量筒量取的浓硫酸,慢慢地沿着玻璃棒注入盛有20mL蒸馏水的小烧杯,搅拌后,立即转移到容量瓶中,再按正确操作配制溶液。
B.往容量瓶转移溶液时,有少量液体溅出。
C.未洗涤稀释浓硫酸的小烧杯
D.定容时俯视刻度线。
E.容量瓶未干燥即用来配制溶液。
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线。
【题目】O2、O3、N2、N4是氧和氮元素的几种单质。回答下列问题:
(1)O原子中价电子占据的轨道数目为______________。
(2)第一电离能I1:N__________O(填“>”或“<”),第二电离能I2:O大于N的原因是_________________。
(3)O3的空间构型为__________________;分子中存在大π键,可用符号Π![]() 表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
表示,其中m表示形成的大π键的原子数,n表示形成的大π键的电子数,则O3中大π键应表示为___________________________________。
(4)N元素的简单气态氢化物NH3在H2O中溶解度很大,其原因之一是NH3和H2O可以形成分子间氢键,则在氨水中氢键可以表示为H3N…H—N、____________________、__________________________(任写两种即可)。
(5)已知:表格中键能和键长数目。
化学键 | 键长/pm | 键能/(kJ·mol-1) |
N-N | 145 | 193 |
N=N | 125 | 418 |
N≡N | 110 | 946 |
N2和N4都是N元素的单质,其中N4是正四面体构型,N原子占据四面体的四个顶点,从键参数角度分析N4分子稳定性远小于N2原因是________________________。
(6)Na2O的晶胞结构如图所示 ,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
,X表示O2-,Y表示Na+,则O2-的配位数为____________,该晶胞的原子空间利用率为_____________。[已知该晶胞的棱长为a pm,r(Na+)=x pm,r(O2-)=y pm]
【题目】某同学通过实验研究Na2O2与水的反应。
操作 | 现象 |
向盛有少量Na2O2的试管中加入蒸馏水,得到溶液a | 反应剧烈,产生能使带火星木条复燃的气体 |
然后向溶液a中滴入两滴酚酞 | 溶液先变红,再逐渐变浅,约10分钟溶液变为无色 |
为了探究溶液变为无色的原因,该同学按照科学的程序,进行了如下实验:
(推理与假设)
Na2O2与H2O反应的化学方程式_____。向溶液a中滴加酚酞本应只会变红,而实验中发现酚酞变红后又褪色。由此提出如下的假设:
假设A:O2有漂白性 假设B:NaOH有漂白性 假设C:O2和NaOH共同作用有漂白性
(实验与观察)
(2)请完成下表:
实验编号 | 1 | 2 | 3 |
实验装置 |
|
|
|
实验假设 (填“A”、“B”或“C”) | 假设_____ | 假设____ | 假设__ |
实验现象 | 溶液变红后10分钟均无变化 | ||
实验结论 | _____ | ||
(查阅资料)
该同学查阅资料:H2O2是一种在碱性条件下不稳定、具有漂白性的物质。
(推理与假设)
该同学认为褪色的原因可能是溶液a中存在H2O2,H2O2漂白了酚酞。
(实验与观察)
(3)通过实验证实了H2O2的存在:取少量溶液a,加入黑色粉末____(填化学式),快速产生了能使带火星木条复燃的气体。该同学进一步通过实验证实了溶液a中滴入酚酞后,H2O2与酚酞发生了化学反应。实验方案:取少量溶液a于试管中,_____。
(解释与结论)
(4
【题目】标准状况下,向100 mLNaOH溶液中缓慢通入一定量的CO2气体,充分反应后,测得最后所得溶液M的PH>7(反应前后溶液的体积变化忽略不计)。在溶液M中逐滴缓慢滴加1 mol/L盐酸,所得气体的体积与所加盐酸的体积关系如图所示:
已知图中B点位置固定,且V(B)=300,而点A C 可在各自的轴上移动。
(1)原溶液的物质的量浓度为_________mol/L,B点时,最终所得溶液中的溶质的物质的量浓度是___________mol/L(两种溶液混合时体积可以直接相加)
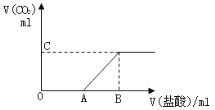
(2)V(A)的取值不同时,溶液M中的溶质的成分也不同,请填写下表:
V(A)的取值 | V(A)=0 | 0<V(A)<150 | V(A)=150 | 150<V(A)<300 |
溶质的成分 | ①__________ | ②___________ | ③_________ | ④_____________ |
当V(A)=200时,C点数值为_____________。
(3)取V(A)=100时对应的溶液M 30ml 与等体积的1 mol/L的盐酸按各种可能的方式混合,产生的气体体积Vml,则V 的取值范围是___________________。