题目内容
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C. 30 mL | D. 15 mL |
A
解析试题分析:生成的混合气体溶于水完全生成HNO3,则整个过程中HNO3反应前后没有变化,即Cu失去的电子都被O2得到了,所以根据得失电子守恒:n(Cu)×2e- = n(O2) ×4e-
n(Cu)×2 =" 1.68/22.4" mol×4
n(Cu)= 0.15mol 所以 Cu(NO3)2为0.15mol
根据 Cu2+~2OH-
0.15mol n(OH-)
则NaOH 为 0.15mol×2="0.3" mol 则NaOH 体积V=n/c=0.3mol/5mol/L=0.06L,即 60 ml,
故选A。
考点:本题考查的是氧化还原反应的计算。

某溶液中含有Cl-和I-的物质的量浓度相同。为了氧化I-而不使Cl-氧化,试根据下列三个反应判断,可选用的氧化剂是:①2Fe3++2I-=2Fe2++I2 ②2Fe2++Cl2=2Fe3++2Cl- ③2MnO4-+10Cl-+16H+=2Mn2++5Cl2↑+8H2O
| A.FeCl2 | B.KMnO4 | C.浓盐酸 | D.FeCl3 |
将51.2gCu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物
共0.9mol,这些气体恰好能被500ml 2mol/LNaOH溶液完全吸收,生成含NaNO3和NaNO2的
盐溶液,其中NaNO3的物质的量为( )
| A.0.2mol | B.0.4mol | C.0.8mol | D.0.9mol |
三氟化氮(NF3)是微电子工业中优良的等离子刻蚀气体,它在潮湿的环境中能发生反应:3NF3+5H2O=2NO+HNO3+9HF,下列有关该反应的说法正确的是
| A.NF3是氧化剂,H2O是还原剂 | B.HF是还原产物 |
| C.还原剂和氧化剂的物质的量之比是2:1 | D.NF3在潮湿的空气中泄漏会产生红棕色气体 |
下列有关说法错误的是( )
| A.H2O2、Na2O2都属于过氧化物、都存在非极性共价键 |
| B.H2O2做漂白剂是利用其强氧化性,漂白原理与HClO类似但与SO2不同 |
| C.双氧水是绿色氧化剂,可作医疗消毒剂 |
| D.H2O2既有氧化性又有还原性,1molH2O2在参加反应时一定转移2mol电子 |
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( )
| A.5.76 | B.2.88 | C.1.44 | D.4.32 |
在100mL含等物质的量的HI和H2SO3的溶液里通入0.14molCl2,有三分之一的HI变为I2(已知:I2+H2SO3+H2O=4H++SO42—+2I—)。原溶液中HI和H2SO3的浓度都等于
| A.8.0 mol?L-1 | B.0.12 mol?L-1 |
| C.0. 8 mol?L-1 | D.1.2 mol?L-1 |
水热法制备纳米颗粒Y(化合物)的反应为:3Fe2++2S2O32-+O2+a OH-=Y+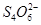 +2H2O下列说法中,不正确的是 ( )
+2H2O下列说法中,不正确的是 ( )
| A.S2O32-是还原剂 | B.Y的化学式为Fe2O3 |
| C.a=4 | D.每有1mol O2参加反应,转移的电于总数为4 mol |
根据表中信息,判断下列叙述中正确的是( )
| 序号 | 氧化剂 | 还原剂 | 其他反应物 | 氧化产物 | 还原产物 |
| ① | Cl2 | FeBr2 | / | | Cl- |
| ② | KMnO4 | H2O2 | H2SO4 | O2 | Mn2+ |
| ③ | KClO3 | 浓盐酸 | / | Cl2 | |
A.表中①组反应可能有一种或两种元素被氧化
B.氧化性强弱比较:KClO3>Fe3+>Cl2>Br2
C.表中②组反应的离子方程式是2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O
D.表中③组反应的还原产物是KCl,电子转移数目是6e-