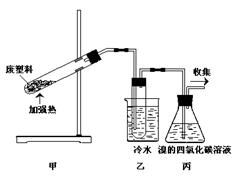
题目内容
下列除去杂质的方法正确的是
| A.除去CO2中的少量CO:通入O2,点燃 |
| B.除去Na2CO3稀溶液中的少量NaHCO3:加热 |
| C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后,过滤 |
| D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液,过滤 |
C
试题分析:A、混入了新杂质O2,故错;B、加热NaHCO3溶液不反应,故错;D、引入新的杂质NaOH,故错。故选C。
点评:物质的分离与除杂是考试的重点,也是难点,解决除杂问题时,抓住除杂质的必需条件(加入的试剂只与杂质反应,反应后不能引入新的杂质)是正确解题的关键。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
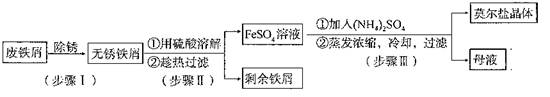
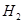 ②
②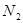 ③
③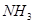 ④
④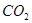 ⑤
⑤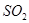 ⑥
⑥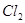 ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )