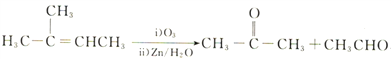题目内容
【题目】利用工业炼铅产生的锌灰(主要成分为ZnO、PbO、FeO、MnO2、CuO)可回收制备ZnCl2,工艺流程如下:
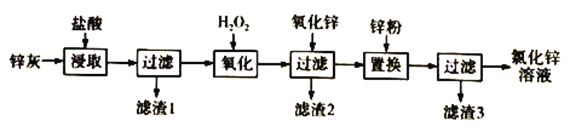
回答下列问题
(1)“浸取”实验中,反应体系的温度、反应时间对锰脱除效果的影响如下表,则适合的温度和反应时间分别是________________、____________________。

(2)“滤渣1”的主要成分是_____________。
(3)H2O2溶液的作用是____________________________________,已知“滤渣2”的主要成分是Fe(OH)3,则氧化锌的作用是_______________________________。“置换”实验中发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、___________________________________。
(4)由锌灰制取金属锌可采用碱溶解,然后电解浸取液,已知:ZnO溶于NaOH溶液中生成[Zn(OH)4]2-,则阴极的电极反应为___________________________________。
(5)ZnCl2晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z,为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式为______________________________。
【答案】 30℃ 2.0h MnO2 将Fe2+氧化为Fe3+ 调节pH将Fe3+转化为沉淀除去 Zn+Cu2+==Zn2++Cu [Zn(OH)4]2-+2e-=Zn+4OH- Zn3CO3(OH)4
【解析】(1)“浸取”实验中,根据表中反应体系的温度、反应时间对锰脱除效果的数据可知,浸出率较高的适合的温度和反应时间分别是30℃、2.0h;(2)MnO2不溶于稀盐酸,故“滤渣1”的主要成分是MnO2;(3)H2O2溶液的作用是将Fe2+氧化为Fe3+,已知“滤渣2”的主要成分是Fe(OH)3,则氧化锌的作用是调节pH将Fe3+转化为沉淀除去;“置换”实验中利用锌置换出未处理的金属性弱的金属,发生的反应的离子方程式有Zn+Pb2+=Ph+Zn2+、Zn+Cu2+==Zn2++Cu;(4)阴极碱性条件下[Zn(OH)4]2-得到电子产生Zn,电极反应为[Zn(OH)4]2-+2e-=Zn+4OH-;(5)浓硫酸增重为分解生成水的质量,水的物质的量为![]() =0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到二氧化碳的质量,二氧化碳物质为
=0.04mol,则n(OH-)=0.08mol,碱石灰增重为分解得到二氧化碳的质量,二氧化碳物质为![]() =0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=
=0.02mol,则n(CO32-)=0.02mol,结合原子守恒,可知(Zn2+)=![]() ×(0.08mol+0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为: Zn3CO3(OH)4。
×(0.08mol+0.02mol×2)=0.06mol,则x:y:z=0.06:0.02:0.08=3:1:4,故该碱式碳酸锌的化学式为: Zn3CO3(OH)4。

【题目】下图是元素周期表的一部分,表中的①~⑨中元素,用元素符号或化学式填空回答:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ |
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为。
(2)地壳中含量最多的金属元素是。
(3)②与④形成的化合物的电子式。
(4)这些元素中的最高价氧化物对应的水化物中,酸性最强的是 , 碱性最强的是 , 呈两性的氢氧化物是。
【题目】SOCl2是一种重要氯化剂、锂电池的正极材料,还可作水合盐酸盐的脱水剂。
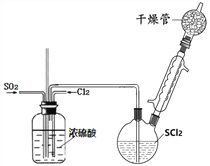
Ⅰ.一种模拟制备SOCl2装置如上图所示(夹持、加热装置略去),双颈瓶中加入25.4mL SCl2,通入纯净干燥Cl2、SO2混合气体,水浴条件下发生反应Cl2+SO2+SCl2=2SOCl2,几种物质的部分性质如下表所示:
密度/ g﹒mL-1 | 熔点/℃ | 沸点/℃ | 备注 | |
SCl2 | 1.62 | -122 | 59 | 40℃分解,遇水分解 |
SOCl2 | 1.64 | -104.5 | 76 | 76℃分解,遇水分解 |
(1)洗气瓶将气体混合并干燥,还有___________作用。
(2)干燥管中碱石灰作用__________。
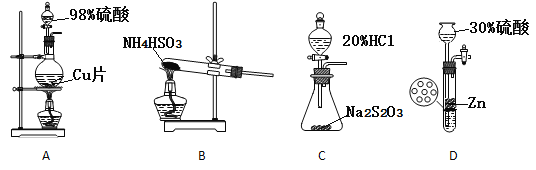
(3)实验室制取SO2装置和药品应选择____。
Ⅱ、双颈瓶换毛细玻璃管和蒸馏头,连接减压蒸馏装置,对粗产品减压初蒸,剩余液体继续减压蒸馏获得产品
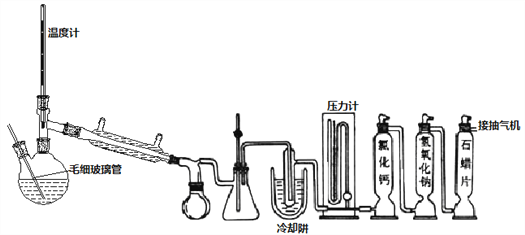
(4)不能用普通蒸馏方法分离混合物的原因是____。
(5)毛细玻璃管C作用是____________。初蒸水浴加热的温度应控制在____℃以下,再蒸馏获得产品25.4mL,则SOCl2产率为__________。