题目内容
NaF、NaI、和MgO均为离子晶体,有关数据如下表:
| 物 质 | ① NaF | ② NaI | ③ MgO |
| 离子电荷数 | 1 | 1 | 2 |
| 键长(10-10m) | 2.31 | 3.18 | 2.10 |
试判断,这三种化合物熔点由高到低的顺序是
A.③>①>② B.③>②>① C.①>②>③ D.②>①>③
A
解析试题分析:离子化合物形成的离子晶体中,离子键的键长越短,阴、阳离子所带电荷越多,则晶体的熔点越高。根据表中数据可知,阴离子半径是I->F->O2-,阳离子半径是Na+>Mg2+,所以根据三种物质所带电荷为③>②=①,键长:③<①<②可知,三种化合物熔点由高到低的顺序是③>①>②,答案选A。
考点:考查离子晶体熔点高低判断

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
关于晶体的下列说法正确的是
| A.晶体中只要有阴离子就一定有阳离子 |
| B.晶体中只要有阳离子就一定有阴离子 |
| C.原子晶体的熔点一定比金属晶体的高 |
| D.分子晶体的熔点一定比金属晶体的低 |
根据下列性质判断,属于原子晶体的物质是
| A.熔点2 700 ℃,导电性好,延展性强 |
| B.无色晶体,熔点3 500 ℃,不导电,质硬,难溶于水和有机溶剂 |
| C.无色晶体,能溶于水,质硬而脆,熔点800 ℃,熔化时能导电 |
| D.熔点-56.6 ℃,微溶于水,硬度小,固态或液态时不导电 |
物质的熔沸点高低能用键能大小解释的是
| A.Na > K | B.O2> N2 | C.H2O > H2S | D.SiO2 > CO2 |
硼和镁形成的化合物刷新了金属化合物超导温度的最高记录。如右图是该化合物的晶体结构单元:镁原子间形成正六棱柱,且棱柱的上下面还各有一个镁原子;6个硼原子位于棱柱的侧棱上,则该化合物的化学式可表示为( )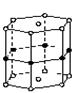
| A.MgB | B.Mg3B2 |
| C.MgB2 | D.Mg2B3 |
已知反应A+B=C+D的能量变化如图所示,下列说法正确的是 ( )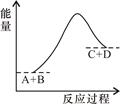
| A.该反应为放热反应 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
下列物质的熔、沸点高低顺序中排列正确的是 ( )
| A.金刚石>晶体硅>碳化硅 | B.CI4>CBr4>CCl4>CH4 |
| C.MgO>O2>N2>H2O | D.金刚石>生铁>纯铁>钠 |
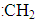 )
)
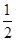 ,n=3、l=1、m=0、ms=+
,n=3、l=1、m=0、ms=+