题目内容
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)Na2CO3溶液显碱性的原因,用离子反应方程式表示_____________________________;CuSO4溶液呈酸性的原因,用离子反应方程式表示:___________________________。
(2)25 ℃时,pH为9的CH3COONa溶液中c(OH-)=________。
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=___________。
【答案】![]() +H2O
+H2O![]()
![]() +OHˉ Cu2++2H2O
+OHˉ Cu2++2H2O![]() 2H++Cu(OH)2 10-5mol/L 中
2H++Cu(OH)2 10-5mol/L 中 ![]()
【解析】
(1)碳酸钠溶液中因存在碳酸根的水解而显碱性,离子方程式为![]() +H2O
+H2O![]()
![]() +OHˉ;硫酸铜溶液中因存在铜离子的水解而显酸性,离子方程式为Cu2++2H2O
+OHˉ;硫酸铜溶液中因存在铜离子的水解而显酸性,离子方程式为Cu2++2H2O![]() 2H++Cu(OH)2;
2H++Cu(OH)2;
(2)25 ℃时,pH为9的CH3COONa溶液中c(H+)=10-9mol/L,溶液中c(OH-)=![]() =10-5mol/L;
=10-5mol/L;
(3)混合溶液中存在电荷守恒c(NH![]() )+c(H+)=c(OH-)+c(Cl-),因为c(NH
)+c(H+)=c(OH-)+c(Cl-),因为c(NH![]() )=c(Cl-),所以c(H+)=c(OH-),溶液显中性;NH3·H2O的电离常数Kb=
)=c(Cl-),所以c(H+)=c(OH-),溶液显中性;NH3·H2O的电离常数Kb=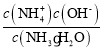 ,溶液显中性,所以c(OH-)=10-7mol/L,c(NH
,溶液显中性,所以c(OH-)=10-7mol/L,c(NH![]() )=c(Cl-),两溶液等体积混合后,氯离子的浓度变为原来的一半为5×10-3mol/L,所以c(NH
)=c(Cl-),两溶液等体积混合后,氯离子的浓度变为原来的一半为5×10-3mol/L,所以c(NH![]() )=5×10-3mol/L,根据物料守恒可知c(NH
)=5×10-3mol/L,根据物料守恒可知c(NH![]() )+ c(NH3·H2O)=0.5amol/L,则c(NH3·H2O)=(0.5a-5×10-3)mol/L,所以Kb=
)+ c(NH3·H2O)=0.5amol/L,则c(NH3·H2O)=(0.5a-5×10-3)mol/L,所以Kb=![]() 。
。