题目内容
【题目】下列叙述中正确的是
A. 苯乙炔中最多有四个原子共直线
B. 2-甲基-1,3-丁二烯与Br2的加成产物有4种
C. 甲苯在一定条件下与H2完全反应,产物的一氯代物的同分异构体有4种
D. 已知具有单双键交替长链(如:—CH=CH—CH=CH—CH=CH—)的高分子有可能成为导电塑料,故聚乙烯和聚乙炔均可成为导电塑料
【答案】B
【解析】A,苯乙炔由苯基和乙炔基相连而成,联想苯和乙炔的结构,由于单键可以旋转,苯乙炔可以写成![]() ,最多图示6个原子共直线,A项错误;B,2-甲基-1,3-丁二烯与Br2可以发生1,2-加成生成
,最多图示6个原子共直线,A项错误;B,2-甲基-1,3-丁二烯与Br2可以发生1,2-加成生成 、
、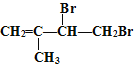 ,发生1,4-加成生成
,发生1,4-加成生成![]() ,两个碳碳双键全加成生成
,两个碳碳双键全加成生成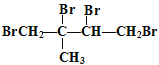 ,共4种,B项正确;C,甲苯在一定条件下与H2完全反应生成
,共4种,B项正确;C,甲苯在一定条件下与H2完全反应生成![]() ,
,![]() 中有5种氢原子,
中有5种氢原子,![]() 的一氯代物的同分异构体有5种,C项错误;D,聚乙烯结构简式为
的一氯代物的同分异构体有5种,C项错误;D,聚乙烯结构简式为![]() ,聚乙烯结构中不含单双键交替长链,聚乙烯不能成为导电塑料,D项错误;答案选B。
,聚乙烯结构中不含单双键交替长链,聚乙烯不能成为导电塑料,D项错误;答案选B。

 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案【题目】下列实验能达到预期目的的是
序号 | 实验内容 | 实验目的 |
A | 将FeCl3固体溶于少量浓盐酸中,再加蒸馏水稀释至所需浓度 | 配制氯化铁溶液 |
B | 常温下,将干电池的温度升高到40℃,其输出电流增大 | 证明干电池可将环境热能转化为电能 |
C | 向CuCl2溶液中加入NaOH调节pH>4 | 除去CuCl2的Fe3+杂质 |
D | 向BaSO4悬浊液中加入Na2CO3饱和溶液,过滤出的沉淀加入盐酸有气体生成 | 证明Ksp(BaCO3)<Ksp(BaSO4) |
A. A B. B C. C D. D
【题目】利用水钴矿[主要成分为Co2O3和Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)提高水钴矿浸出速率的措施有_______________________________________(填写两点),浸出过程中Co2O3发生反应的离子方程式为________________________。
(2)NaClO3的作用是_________________________________。
(3)加Na2CO3调pH至5.2所得沉淀为_________________。
(4)萃取剂对金属离子的萃取率与pH的关系如图。萃取剂的作用是___________________________________________;其使用的适宜pH范围是______________。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5

(5)由萃取后余液获得粗产品的操作步骤为_____________。
