题目内容
14.下列有关化学与生活、工业的叙述中,不正确的是( )| A. | 工业生产玻璃、水泥、漂白粉,均需要用石灰石为原料 | |
| B. | CO会与血红蛋白结合,使人中毒;可将中毒病人放入氧仓中解毒,其解毒原理符合平衡移动原理 | |
| C. | 2011年5月份起,面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物 | |
| D. | 固体煤经处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
分析 A.根据工业生产玻璃、水泥、漂白粉的原料分析解答;
B.利用平衡逆向分析移动CO中毒的病人放人高压氧舱中解毒的原理;
C.碱性氧化物是指能跟酸起反应,生成盐和水的氧化物;
D.将煤制成气体燃料煤气,燃烧充分,可减少大气污染.
解答 解:A.制普通玻璃的原料:石英砂、石灰石、纯碱等;制硅酸盐水泥的原料:石灰石和黏土;制漂白粉的原料:用石灰石可以制得氧化钙进而得到消石灰,用氯气与消石灰反应得到漂白粉;均需要用石灰石为原料,故A正确;
B.CO中毒反应CO+HbO2?O2+HbCO,中毒的病人放入高压氧舱中,使氧气浓度增大,化学平衡逆向移动,使CO从血红蛋白中脱离出来,故B正确;
C.CaO2跟酸起反应,生成盐和水和氧气,不属于碱性氧化物,故C错误;
D.将固体煤炭处理,使其变为气体燃料可以脱硫,燃烧充分,可以减少SO2和烟尘的排放,有利于“节能减排”,故D正确;
故选C.
点评 本题考查有关化学与生活、工业的有关知识,掌握工业生产玻璃、水泥、漂白粉的原料、CO中毒原理、有机物、氧化物的判别、固体煤经处理变为气体燃料的优点是解答的关键,题目难度不大,平时需注意把握相关物质的性质及应用,学习中注意积累.

练习册系列答案
相关题目
12.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
| A. | X与Y形成化合物时X显负价,Y显正价 | |
| B. | 第一电离能X大于Y | |
| C. | 最高价氧化物对应的水化物的酸性:X强于Y | |
| D. | 气态氢化物的稳定性:HmX强于HmY |
13.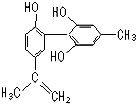 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
 坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
坚决反对运动员服用兴奋剂是保证运动会公平公正的重要举措之一.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| B. | 该分子中的所有碳原子不可能共平面 | |
| C. | 滴入KMnO4(H+)溶液,观察紫色变浅,是因为结构中存在碳碳双键 | |
| D. | 1 mol该物质分别与浓溴水和H2反应时,最多消耗Br2和H2分别为4 mol、7 mol |
2.已知H2?C3H8的燃烧热分别为285.8kJ•mol-1和2220.0kJ•mol-1,实验测得H2和C3H8的混合气体共5mol,完全燃烧时放热3847kJ,则混合气体中H2和C3H8的体积约为( )
| A. | 1:3 | B. | 3:1 | C. | 1:4 | D. | 5:13 |
19.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径:r(A)>r(B)>r(D)>r(C) | B. | 离子半径:r(C3-)>r(D-)>r(B+)>r(A2+) | ||
| C. | 原子序数:d>c>b>a | D. | 单质的还原性:A>B>D>C |
6.下列说法错误的是( )
| A. | 钠和铁一样,都能在氯气中燃烧生成金属氯化物 | |
| B. | 氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸 | |
| C. | 氯气跟变价金属反应生成高价金属氯化物 | |
| D. | 液氯是氯气的水溶液,它能使干燥的有色布条褪色 |
3.现有下列各项关于不同状态的物质属性的描述:
①构成微粒间有较大空隙;
②构成微粒可以自由移动;
③没有固定形状;
④不易被压缩.
某物质具备下列哪种组合的属性能够判断该物质为液体( )
①构成微粒间有较大空隙;
②构成微粒可以自由移动;
③没有固定形状;
④不易被压缩.
某物质具备下列哪种组合的属性能够判断该物质为液体( )
| A. | ①和④ | B. | ②和③ | C. | ①和③ | D. | ②和④ |
4.在由水电离产生的c(H+)=1×10-14mol•L-1的某无色溶液中一定能大量共存的是( )
| A. | Fe2+.K+.SO42-.NO3- | B. | Mg2+.NH4+.SO42-.C1- | ||
| C. | Na+.K+.SO42-.NO3- | D. | Ba2+.Na+.SO42-.MnO4- |