题目内容
以食盐为原料进行生产并综合利用的某些过程如下图所示。
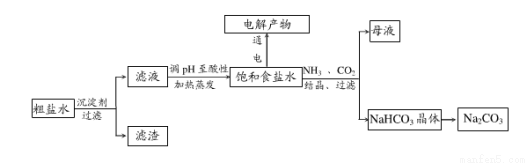
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_____。
A.Na2CO3 B.NaOH C.BaCl2
(2)将滤液的pH调至酸性除去的离子是________。
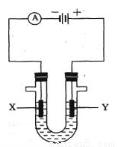
(3)下图表示电解饱和NaCl溶液的装置,X、Y是石墨棒。实验开始时,在两边同时各滴入几滴酚酞溶液,请回答以下问题:X极上的电极反应式是________,在X极附近观察到的现象是________,电解NaCl溶液的离子方程式是_________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的气体,其化学式是________。
(1)C、B、A(或B、C、A);(2)CO32-和OH-;(3)2H++2e-=H2↑有无色气泡产生,溶液变红;2Cl-+2H2O Cl2↑+H2↑+2OH-(4)NH3
Cl2↑+H2↑+2OH-(4)NH3
【解析】
试题分析:(1)首先向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,然后向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;最后加入Na2CO3 ,发生反应Ca2++ CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是B、C、A。也可以是首先向溶液中加入BaCl2溶液发生反应:Ba2++SO42-= BaSO4↓,除去SO42-;然后向溶液中加入NaOH溶液,发生反应:Mg2++2OH-=Mg(OH)2↓除去Mg2+;,最后加入Na2CO3发生反应Ca2++CO32-= CaCO3↓,Ba2++CO32-= BaCO3↓,将原来溶液中的Ca2+及过量的沉淀试剂的Ba2+沉淀除去。加入下列沉淀剂的顺序是C、B、A。
(2)过滤后溶液中含有过量的NaOH、Na2CO3。这时向溶液中加入盐酸,发生反应:H++ OH-= H2O; CO32-+2H+=CO2↑+H2O;因此将滤液的pH调至酸性除去的离子是CO32-和OH-。
(3)在电极食盐水的装置中,与电源正极相连的Y电极为阳极,由于阴离子Cl-、OH-的放电能力Cl->OH-。所以在电极Y上发生的反应为:2Cl—--2e-=Cl2↑; 与电源负极相连的X电极为阴极,由于阳离子H+、Na+的放电能力H+>Na+。所以在电极X上发生的反应为:2H++2e-=H2↑;由于H+不断放电消耗,破坏了附近的水的电离平衡,水会继续电离直至达到新的平衡状态,最终导致附近的溶液中C(OH-)>C(H+),因此滴入几滴酚酞溶液后,在X电极附近溶液变为红色。电解NaCl溶液的离子方程式是2Cl-+2H2O Cl2↑+H2↑+2OH-。
Cl2↑+H2↑+2OH-。
(4)发生反应后的母液中含有大量的NH4Cl,若向分离出NaHCO3晶体后的母液中加入过量生石灰,会发生反应CaO+ H2O= Ca(OH)2,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
CaCl2+2NH3↑+ 2H2O。其中可以循环使用的气体是NH3。
考点:考查粗盐中杂质的除去的方法、步骤及电解食盐水的反应原理、现象和物质的综合利用的知识。