题目内容
【题目】实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯。
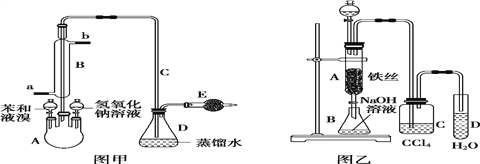
Ⅰ.若用图甲装置进行制备实验,回答下列问题:
(1)A 中预先需加入的试剂是___________,E 中需加入的试剂是____________。
(2)仪器 B 的作用是_________,__________________。
Ⅱ.若用图乙装置进行制备实验,回答下列问题:
(1)C 中盛放 CCl4 的作用_________;
(2)实验结束时,打开 A 下端的活塞,让反应液流入 B 中,充分振荡,写出有关的离子方程式:
________________________,然后用__________________(填仪器名称)分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管 D 中滴加 AgNO3 溶液,________________(填现象),此现象说明由苯与液溴获得溴苯的反应属于___________________________(填有机反应类型)。
【答案】 Fe或FeBr3 碱石灰 导气 冷凝 吸收HBr中未反应的溴蒸汽 Br2+2OH-===Br-+BrO-+H2O 分液漏斗 有浅黄色沉淀生成 取代反应
【解析】Ⅰ.(1)苯与液溴的反应是需要催化剂溴化铁或铁粉,在催化剂作用下苯和溴发生取代反应生成溴苯和溴化氢;E中需加入的试剂是吸收溴化氢的固体物质碱石灰,故答案为:Fe或FeBr3;碱石灰;
(2)仪器B除导气外的作用还起到冷凝回流反应物,使反应物充分利用; 故答案为:导气;冷凝;
Ⅱ.(1)溴单质易溶解于四氯化碳中,通过CCl4的作用是吸收溴化氢中的溴单质,故答案为:吸收HBr中的溴蒸汽;
(2)实验结束时,打开A下端的活塞,让反应液流入B氢氧化钠溶液中,吸收溴单质,发生反应的离子反应式为Br2+2OH-=Br-+BrO-+H2O,经充分振荡静置分层,利用分液漏斗分液分离出溴苯,故答案为:Br2+2OH-=Br-+BrO-+H2O;分液漏斗;
(3)试管D中吸收的是溴化氢气体,生成了溴化氢溶于水中电离出溴离子和银离子,加入硝酸银反应生成淡黄色沉淀溴化银,说明溴单质和苯的反应是发生了取代反应,故答案为:浅黄色沉淀;取代。

【题目】X、Y、Z、M、R、Q、W均为短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | Q | W | |
原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | 0.077 | ||
主要化合价 | -4,+4 | -2 | -1,+7 | +3 | -4,+4 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 焰色反应呈黄色 |
(1)Y在元素周期表中的位置是_____。
(2)写出化合物XRM的电子式:_____;比较Z、M、R三种元素对应的简单离子半径大小_____。(用离子符号和“>”表示)
(3)Z与Q相比,金属性较强的是_____(用元素符号表示),下列事实能证明这一结论的是
_____(选填字母序号)。
a.Z的熔点低于Q
b.常温下,Z与水剧烈反应而Q不能
c.最高价氧化物对应的水化物碱性:ZOH > Q(OH)3
d.最外层电子数:Q > Z