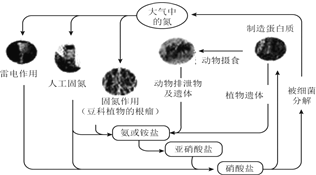
��Ŀ����
����Ŀ����ʹ������к͵ζ����ⶨ���۰״������� (g/100mL )��
I��ʵ�鲽�裺
(1)��_____ (���������� )��ȡ10.00mL ʳ�ð״ף���_____ (���������� )����ˮϡ�ͺ�ת�Ƶ�100mL_____ (���������� )�ж��ݣ�ҡ�ȼ��ô���״���Һ��
(2)��_____ɫ�ֱ��ζ���ȡ����״���Һ 20.00mL ����ƿ�У������еμ�2��_____��Ϊָʾ����
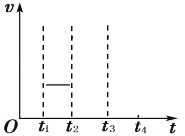
(3)��ȡʢװ0.1000mol/L NaOH ��Һ�ĵζ��ܵij�ʼ���������Һ��λ����ͼ��ʾ ���ʱ�Ķ���Ϊ_____mL��
![]()
(4)�ζ�����_____ʱ��ֹͣ�ζ�������¼ NaOH��Һ���ն������ظ��ζ� 3 �Ρ�
II��ʵ���¼
�ζ����� ʵ������ (mL ) | 1 | 2 | 3 | 4 |
V (��Ʒ ) | 20.00 | 20.00 | 20.00 | 20.00 |
V (NaOH ) (���� ) | 15.95 | 15.00 | 15.05 | 14.95 |
(5)��ͬѧ�ڴ�������ʱ�����ƽ�����ĵ�NaOH��Һ�����Ϊ��V�� (15.95+15.00+15.05+14.95 )/4��15.24(mL)��ָ�����ļ���IJ�����֮����_____�� ����ȷ���ݴ������ɵ�c (���۰״�)��_____mol/L��
(6)�ڱ�ʵ��ĵζ������У����в�����ʹʵ����ƫ�����_____ (��д���)
a��ʢװNaOH�ĵζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ
b��ʢװ����״ĵζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ
c����ƿ�м������״���Һ���ټ�����ˮ
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��
���𰸡���ʽ�ζ��� �ձ� ����ƿ �� ��̪ 0.60 ��Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ ��1�εζ��������ƫ�����쳣ֵ��Ӧ��ȥ 0.075 ab
��������
(1 )������ȡҺ������ľ�ȷ���Լ�Һ�������ѡ����������Һ�Ķ����ڶ�Ӧ���������ƿ�н��У�
(2 )��ɫ�ֱ��ĵζ���Ϊ��ʽ�ζ��ܣ���ɫ�ֱ��ĵζ���Ϊ��ʽ�ζ��ܣ�����������������Һǡ�÷�Ӧʱ���ɴ����ƣ���Һ�ʼ��ԣ����÷�̪��ָʾ����
(3 )���ݵζ��ܵĽṹ�뾫ȷ����������
(4 )��ǰΪ��ɫ���ζ�������Ϊdz��ɫ���ݴ��жϵζ��յ�����
(5 )�������ݵĺ��������ƽ�����ĵ�NaOH��Һ�������Ȼ����ݰ״���NaOH ��Һ��Ӧ�Ĺ�ϵʽ��CH3COOOH��NaOH�����
(6 )����c (���� )��![]() ��������������V (�� )��Ӱ�죬�Դ��ж�Ũ�ȵ���
��������������V (�� )��Ӱ�죬�Դ��ж�Ũ�ȵ���
(1 )��ʽ�ζ��ܾ�ȷ��Ϊ0.01ml��Ӧѡ����ʽ�ζ�����ȡ�״ף�����ʽ�ζ�����10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�ж��ݣ�ҡ�ȼ��ô���״���Һ��
�ʴ�Ϊ����ʽ�ζ��ܣ��ձ�������ƿ��
(2 )��������ԣ���Ҫ�ú�ɫ�ֱ��ĵζ��� (��ʽ�ζ��� )��ȡ��
���ڴ�������Һ��ʾ���ԣ����÷�̪��ָʾ����������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪���ʴ�Ϊ���죻��̪��
(3 )����ͼʾ��֪���ζ���Һ��Ķ���0.60mL���ʴ�Ϊ��0.60��
(4 )NaOH�ζ�ʳ��ʱ���ζ�����ǰΪ��ɫ���ζ�������Ϊdz��ɫ����ζ��յ�����Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
�ʴ�Ϊ����Һ����ɫǡ�ñ�Ϊ��ɫ�����ڰ�����ڲ���ɫ��
(5 )��1�εζ�������Դ����쳣ֵ��Ӧ��ȥ��3������NaOH��Һ�����Ϊ��15.00mL��15.05mL��14.95mL����NaOH��Һ��ƽ�����Ϊ15.00mL�����ݹ�ϵʽCH3COOOH��NaOH��֪��n (CH3COOOH )��n (NaOH )��0.1000mol/L��0.015L��0.0015mol��c (���۰״� )��![]() ��0.075molL��1��
��0.075molL��1��
�ʴ�Ϊ����һ��������Դ����쳣ֵ��Ӧ��ȥ�� 0.075��
(6 )a����ʽ�ζ����ڵζ�ʱδ�ñ�NaOH��Һ��ϴ����ҺŨ�Ƚ��ͣ����V (�� )ƫ�ⶨ��ҺŨ��ƫ�ߣ���a��ȷ��
b����ʽ�ζ��ܵļ����ڵζ�ǰ�����ݣ��ζ���������ʧ�����V (�� )ƫ����ҺŨ��ƫ�ߣ���b��ȷ��
c����ƿ�м������״���Һ���ټ�����ˮ����V (�� )��Ӱ�죬��ҺŨ�Ȳ��䣬��c����
d����ƿ�ڵζ�ʱ����ҡ����������Һ�彦��������Һ�����ʵ����ʵ���ƫС�����V (�� )ƫС����ҺŨ��ƫ�ͣ���d����
�ʴ�Ϊ��ab��

 ��ѧʵ����ϵ�д�
��ѧʵ����ϵ�д�����Ŀ����ͼ��ʾ�Ĺ�����Ŀǰֱ������̫���ܵ��о��ȵ㡣���ǰ�ͨ���˹��⻯ѧ�ֶκϳ�ȼ�ϵĹ��̽����˹�������á�
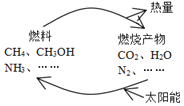
��1����ͼ��������ʺ�����ѭ����̫��������ת��Ϊ___�ܣ�
��2���˹�������õ�;��֮һ�����ڴ������������£���CO2��H2Oת��ΪCH3OH(�״�)���÷�Ӧ�Ļ�ѧ����ʽΪ��2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)��
2CH3OH(g)+3O2(g)��
һ�������£���2L�ܱ������н���������Ӧ�����n(CH3OH)��ʱ��ı仯�����ʾ��
ʱ��/min | 0 | 1 | 2 | 3 | 4 | 5 | 6 |
n(CH3OH)/mol | 0.000 | 0.040 | 0.070 | 0.090 | 0.100 | 0.100 | 0.100 |
��CH3OH��H2O�ֱ��ʾ0��3min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ___mol/(L��min)-1��____mol/(L��min)-1��
����˵���÷�Ӧ�Ѵﵽƽ��״̬����___(�����)��
A.v��(H2O)=2v��(CO2) B.n(CH3OH)��n(O2)=2��3
C.������ѹǿ���ֲ��� D.�����ڻ�������ܶȱ��ֲ���
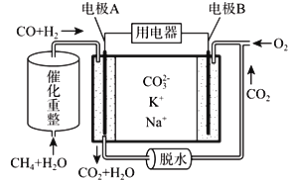
��3�����˹�������õõ��ļ״���������ϡ��������ȼ�ϵ�أ���״�Ӧͨ���ȼ�ϵ�ص�____�������������������ɲ���ƽͨ������һ���ĵ缫��Ӧʽ��___��