题目内容
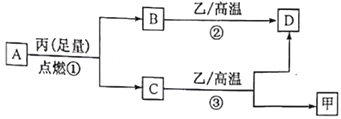
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是
A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
【答案】D
【解析】
A与C中均含有10个电子,A燃烧可生成C,由转化关系可知A应为CH4,丙为O2,B为CO2,C为H2O,B、C都可与乙在高温下反应,乙应为C,则D为CO,甲为H2,则X为H元素,Y为C元素,Z为O元素,以此解答该题。
由以上分析可知X为H元素,Y为C元素,Z为O元素,A为CH4,丙为O2,B为CO2,C为H2O,乙为C,D为CO,甲为H2。
A.由以上分析可知X为H元素,Y为C元素,Z为O元素,同周期元素从左到右原子半径逐渐减小,不同周期的元素,原子核外电子层数越多,原子半径越大,所以原子半径:Y>Z>X,A错误;
B.X为H元素,Y为C元素,二者形成的化合物,如CH4只含极性键,C2H6、C2H4等既含极性键,也含有非极性键,B错误;
C. Y为C元素,C元素有多种同素异形体,其中金刚石具有高熔点、高沸点、硬度大的性质,而石墨则质地软,C错误;
D.A 是CH4,C是H2O,元素的非金属性O>C,元素的非金属性越强,其最简单的氢化物的稳定性就越强,所以气态氢化物的稳定性A<C,D正确;
故合理选项是D。

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目