题目内容
甲醇广泛用作燃料电池的燃料,可用天然气来合成,已知:
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ?mol-1
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1
下列结论错误的是( )
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ?mol-1
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1
下列结论错误的是( )
| A、由CH4(g)制取1mol CH3OH(l)所放出的热量为126kJ |
| B、甲醇的燃烧热为764kJ?mol-1 |
| C、80g甲醇完全燃烧生成气态水时放出的热量为1910kJ |
| D、反应②在低温下可以自发进行 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、据盖斯定律,利用①②反应可得;
B、据盖斯定律利用反应①②③求得甲醇燃烧的热化学方程式可得;
C、利用盖斯定律求出甲醇燃烧的热化学方程式即可解答;
D、根据△G=△H-T△S判断,△G<0反应自发进行,△G>0反应不能自发进行.
B、据盖斯定律利用反应①②③求得甲醇燃烧的热化学方程式可得;
C、利用盖斯定律求出甲醇燃烧的热化学方程式即可解答;
D、根据△G=△H-T△S判断,△G<0反应自发进行,△G>0反应不能自发进行.
解答:
解:已知:
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ?mol-1
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1
A、据盖斯定律①+②×2得:2CH4(g)+O2(g)═2CH3OH(l)△H=-252kJ?mol-1,生成1mol甲醇放热126KJ,故A正确;
B、据盖斯定律③×2-①-②×2得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△=-1528KJ/mol,所以,甲醇的燃烧热为764kJ?mol-1,故B正确;
C、80g甲醇为2.5mol,完全燃烧生成液态水时放热2.5mol×764kJ?mol-1=1910KJ,故C错误;
D、反应②的△H<0,△S<0,反应是否自发进行与温度有关,在低温下,△H-T△S<0,反应可以自发进行,故D正确.
故选:C.
①2CH4(g)+O2(g)═2CO(g)+4H2(g)△H=-71kJ?mol-1
②CO(g)+2H2(g)═CH3OH(l)△H=-90.5kJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890kJ?mol-1
A、据盖斯定律①+②×2得:2CH4(g)+O2(g)═2CH3OH(l)△H=-252kJ?mol-1,生成1mol甲醇放热126KJ,故A正确;
B、据盖斯定律③×2-①-②×2得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△=-1528KJ/mol,所以,甲醇的燃烧热为764kJ?mol-1,故B正确;
C、80g甲醇为2.5mol,完全燃烧生成液态水时放热2.5mol×764kJ?mol-1=1910KJ,故C错误;
D、反应②的△H<0,△S<0,反应是否自发进行与温度有关,在低温下,△H-T△S<0,反应可以自发进行,故D正确.
故选:C.
点评:本题考查反应热的计算、燃烧热概念,难度中等,注意表示燃烧热的热化学方程式,可燃物为1mol,一般H→H2O(l),C→CO2,S→SO2.

练习册系列答案
相关题目
下列关于有机化合物的认识正确的是( )
| A、天然油脂是高分子化合物,同时也是混合物 |
| B、淀粉、纤维素的分子式都是(C6H10O5)n,二者互为同分异构体 |
| C、氨基酸和蛋白质分子中都含有氨基和羧基,二者均有两性 |
| D、糖类、油脂、蛋白质均能发生水解 |
铅蓄电池是可充电型电池,电池总反应为:Pb+PbO2+2H2SO4
2PbSO4+2H2O,下列说法正确的是( )
| 放电 |
| 充电 |
| A、该蓄电池放电工作时SO42-向正极移动 |
| B、充电时阳极的电极反应式是Pb+SO42--2e-═PbSO4 |
| C、用铅蓄电池电解氯化钠溶液,当阳极上收集到11.2L氯气时(标况下),理论上负极板的质量增加48g |
| D、铅蓄电池为电解电源,当蓄电池中有0.4mol H+被消耗时,电路中通过的电子的物质的量为0.4mol |
下列关于煤的叙述中不正确的是( )
| A、煤是工业上获得芳香烃的一种重要来源 |
| B、煤的干馏过程属于化学变化 |
| C、煤是由多种有机物组成的混合物 |
| D、煤除了主要含有碳元素外,还含有少量的氢、氮、硫、氧等元素 |
某有机物的结构为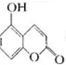 ,下列有关说法正确的是( )
,下列有关说法正确的是( )
 ,下列有关说法正确的是( )
,下列有关说法正确的是( )| A、1mol该物质与足量浓溴水反应,最多消耗2mol Br2 |
| B、1mol该物质最多能与2mol NaOH反应 |
| C、1mol该物质最多能与3mol H2加成 |
| D、该物质的核磁共振氢谱共有6个吸收峰 |
下列说法错误的是( )
| A、MnO2、CuO、Fe三种物质的粉末都是黑色的,用浓盐酸不能将它们区别开 |
| B、虽然碘易溶于酒精而不易溶于水,但是不能用酒精来萃取碘水中的碘 |
| C、用湿润的KI淀粉试纸可以检验氯化氢气体中是否含有氯气 |
| D、用KSCN溶液可以检验硫酸亚铁溶液中是否含有铁离子 |
下列对淀粉、纤维素的叙述正确的是( )
| A、它们的组成都是(C6H10O5)n,但n值不同,因此淀粉、纤维素互为同系物 |
| B、它们都不溶于水,在热水中颗粒会膨胀破裂,发生酯化作用 |
| C、它们都属于高分子化合物,一定条件下都可以水解,最终产物都是葡萄糖 |
| D、淀粉是还原性糖,纤维素是非还原性糖 |
已知2SO2+O2?2SO3为放热反应,关于该反应的下列说法正确的是( )
| A、O2的能量一定高于SO2的能量 |
| B、因该反应为放热反应,故不必加热反应就可发生 |
| C、SO2的能量一定高于SO3的能量 |
| D、SO2和O2的总能量一定高于SO3的总能量 |