题目内容
 Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.
Na-Al/FeS是一种可充电电池,电池中用含Na+导电固体作为电解质,在工作过程中Na+的物质的量保持不变.(1)若该正极的电极反应式表示为:2Na++FeS+2e-=Na2S+Fe,则电池的负极反应式可表示为
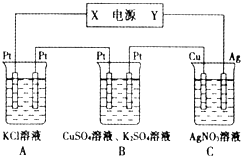
(2)用该电池作电源,组成如图所示装置,若通电5min时,铜电极质量增加1.08g,则该电源电极X名称为
考点:原电池和电解池的工作原理
专题:电化学专题
分析:(1)Na和Al都属于金属,合金中Na较Al活泼,根据正极反应式知,原电池的电极材料Na-Al/FeS,判断出负极材料为Na,失去电子,化合价升高;又知该电池中正极的电极反应式为:2Na++FeS+2e-=Na2S+Fe,所以电池总反应为:2Na+FeS=Na2S+Fe,充电时为电解池原理,阳极发生氧化反应,失去电子,化合价升高;
(2)若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,结合电极方程式解答该题.
(2)若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,结合电极方程式解答该题.
解答:
解:①Na性质活泼,易失去电子而被氧化,应为原电池的负极,电极方程式为2Na-2e-=2Na+,充电时,阳极发生氧化反应,电极方程式为Na2S+Fe-2e-=2Na++FeS,则阳极发生反应的物质是Na2S、Fe,
故答案为:2Na-2e-=2Na+;Na2S、Fe;
②若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,A为电解KCl溶液,电解方程式为2KCl+2H2O
2KOH+H2↑+Cl2↑,溶液pH增大,C中阳极上Ag失电子、阴极上银离子得电子,则溶液中氢离子或氢氧根离子浓度不变,溶液的pH不变,
故答案为:负极;增大;不变.
故答案为:2Na-2e-=2Na+;Na2S、Fe;
②若通电5min时,铜电极质量增加1.08g,说明Cu为阴极,则X为负极,Y为正极,A为电解KCl溶液,电解方程式为2KCl+2H2O
| ||
故答案为:负极;增大;不变.
点评:本题综合考查原电池和电解池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池、电解池的工作原理以及电极方程式的书写,难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
下列表示对应反应的离子方程式正确的是( )
| A、用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2+2H+═I2+2H2O | ||||
| B、硝酸银溶液中滴加过量氨水:Ag++NH3?H2O═AgOH↓+NH4+ | ||||
C、用惰性电极电解氯化镁溶液:2Cl-+2H2O
| ||||
| D、碳酸氢钠的水解:HCO3-+H2O?CO32-+H3O+ |
下列说法正确的是( )
| A、用NaOH溶液区分乙醇和乙醛 |
| B、可用饱和Na2CO3溶液除去CO2中的SO2 |
| C、实验室用浓硫酸干燥Cl2或H2 |
| D、仅用新制Cu(OH)2检验淀粉水解程度 |
镭是元素周期表中第7周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
| A、在化合物中呈+2价 |
| B、单质能与水反应放出氢气 |
| C、氢氧化镭比氢氧化钙的碱性弱 |
| D、碳酸镭难溶于水 |
下列化学用语表述正确的是( )
| A、CH3COONH4的电离方程式为:CH3COONH4═CH3COO-+NH4+ | ||||
| B、NaHS的水解方程式为:HS-+H2O═S2-+H3O+ | ||||
| C、次氯酸的结构式为:H-O-Cl | ||||
D、过量Fe粉与Cl2反应的化学方程式为:Fe+Cl2
|
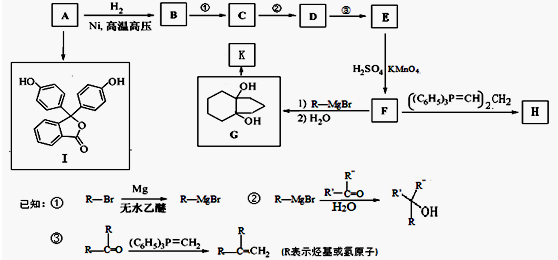
 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
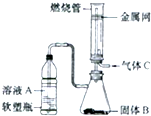 实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )
实验室可将硬质玻璃管改装为燃烧管(如图所示).挤压软塑料瓶壁,向装有固体B的锥形瓶中加入液体A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).若用此装置模拟工业制氯化氢,则关于试剂选择正确的是( )