题目内容
8.向下列溶液中滴加稀H2S04,一开始出现白色沉淀,继续滴加稀H2S04,沉淀又溶解的是( )| A. | AlCl3 | B. | NaAl02 | C. | Mgcl2 | D. | BaCl2 |
分析 先判断硫酸与各选项物质是否发生反应,若反应是否有白色沉淀生成,再判断白色沉淀是否溶于硫酸,据此解答.
解答 解:A、AlCl3与H2SO4不反应,不产生白色沉淀现象,故A错误;
B、NaAlO2与H2SO4反应:2NaAlO2+H2SO4+2H2O=2Al(OH)3↓+Na2SO4,生成Al(OH)3白色沉淀,继续滴加稀硫酸,Al(OH)3又与H2SO4反应:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,沉淀溶解,故B正确;
C、MgCl2与H2SO4不反应,不产生白色沉淀现象,故C错误;
D、BaCl2与H2SO4反应产生白色沉淀BaSO4,BaSO4不溶于硫酸,继续滴加稀硫酸,沉淀不溶解,故D错误;
故选B.
点评 本题考查物质之间的反应,注意现象是反应的体现,关键是清楚物质的性质及物质间的反应,注重基础知识的积累,题目难度不大.

练习册系列答案
相关题目
18.下列比较中,正确的是( )
| A. | 同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的 pH 比 NaCN 溶液大 | |
| B. | 0.2 mol•L-lNH4CI 和 0.l mol•L-lNaOH 溶液等体积混合后:c(NH4+)>c (Cl-)>c (Na+)>c (OH-)>c (H+) | |
| C. | 物质的量浓度相等的 H2S 和 NaHS 混合溶液中:c (Na+)+c(H+)=c (S2-)+c (HS-)+c (OH-) | |
| D. | 同浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl ③CH3COONH4④NH3•H2O; c(NH4+) 由大到小的顺序是:①>②>③>④ |
16.下列说法中,错误的是( )
| A. | 天然气的主要成分是CH4 | |
| B. | 酸性:乙酸>碳酸>次氯酸 | |
| C. | 淀粉、纤维素、蚕丝、油脂都是高分子化合物 | |
| D. | 石油的分馏产品如汽油、煤油、柴油等都是混合物 |
13.向100mL0.5mol/L的硫酸铝溶液中加入1.5mol/L的K0H溶液,要得到3.12g氢氧化铝白色沉淀时需要K0H溶液的体积是( )
| A. | 80mL或240mL | B. | 150mL | C. | 80mL或150mL | D. | 60mL或150mL |
16.已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A. | H2O ( g )═H2 ( g )+$\frac{1}{2}$O2 ( g )△H=+242 kJ/mol | |
| B. | 2H2 ( g )+O2( g )═2H2O ( l )△H=-484 kJ/mol | |
| C. | H2 ( g )+$\frac{1}{2}$O2 ( g )═H2O (g )△H=+242 kJ/mol | |
| D. | 2H2 ( g )+O2 ( g )═2H2O ( g )△H=+484 kJ/mol |
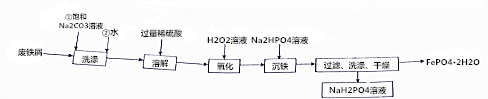
 ;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.
;Na2HPO4的电离方程式为Na2HPO4=2Na++HPO42-.