题目内容
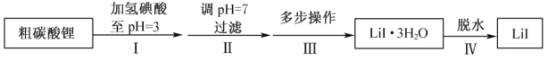
【题目】Ⅰ.某化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3 ,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7 ·2H2O),其主要工艺流程如下图:

查阅资料得知:
i.常温下,NaBiO3 不溶于水,有强氧化性,在碱性条件下,能将 Cr 3+ 转化为CrO42- 。
ii.

回答下列问题:
(1)步骤③加的试剂为氢氧化钠溶液,此时溶液 pH 要调到5的目的是_________ 。
(2)写出④反应的离子反应方程式:________________
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是____________ (填操作名称)。
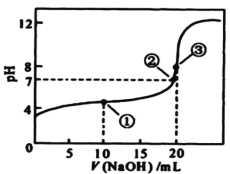
(4)取一定质量的固体 D 溶解于 200mL 的硫酸中,向所得溶液中加入5mol/L 的NaOH 溶液,生成沉淀的物质的量n与加入NaOH 溶液的体积V 关系如图所示,则硫酸的浓度为_______ ,固体 D 中含铁化合物的物质的量为__________ 。

Ⅱ.经检测该化工厂的工业废水中含 5.00×10 -3 mol·L -1 的 Cr2O72- ,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4 (Fe 的化合价依次为+3、+2),又设计了如下工艺流程:

(1)第①步反应的离子方程式_______________ 。
(2)欲使 1L 该废水中的 Cr2O72- 完全转化为 Cr 0.5 Fe 1.5 FeO4 。理论上需要加FeSO4 ·7H2O 的质量为 ________g (已知 FeSO 4 ·7H2O 的摩尔质量为 278g/mol)。
【答案】使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去 3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3 重结晶 2.5mol/L 0.1mol Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O 13.9
【解析】
Ⅰ.铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液E含有Cr3+,在溶液E中加入NaBiO3和NaOH,发生氧化还原反应,固体G为Bi(OH)3,溶液F含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O72H2O,以此解答该题。
Ⅱ.Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成.再根据电子转移守恒、电荷守恒、原子守恒配平;根据Cr原子计算Cr0.5Fe1.5FeO4的物质的量,结合Cr0.5Fe1.5FeO4的物质的量,利用Fe原子守恒计算FeSO47H2O质量。
(1)根据表格数据分析,步骤③加的试剂为氢氧化钠溶液,此时溶液pH要调到5的目的使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀,
故答案为:使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去;
(2)在溶液E中加入NaBiO3和NaOH,发生氧化还原反应,固体G为Bi(OH)3,反应的离子方程式为3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3,
故答案为:3NaBiO3+2Cr3++7OH+H2O=2CrO42+3Na++3Bi(OH)3;
(3)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,此操作为重结晶,
故答案为:重结晶;
(4)由图象可知加入NaOH200mL时沉淀完全,此时溶液为![]() ,则
,则![]() ,
,![]() ,加入
,加入![]() 200mL~240mL时发生
200mL~240mL时发生![]() ,则
,则![]() ,从20mL到200mL,生成
,从20mL到200mL,生成![]() 和
和![]() ,
,![]() ,所以固体D中含
,所以固体D中含![]() 化合物的物质的量为0.1mol,
化合物的物质的量为0.1mol,
故答案为:2.5mol/L;0.1mol;
Ⅱ. (1) Cr2O72-有较强氧化性,FeSO47H2O中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+ ,根据元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O,
故答案为:Cr2O72-+14H++6Fe2+=2Cr3+ +6Fe3++7H2O;
(2) 1L废水中含n(Cr2O72-) = 5.00×10-3mol,根据Cr原子、Fe原子守恒,可得Cr2O72-~ 4Cro.5Fe1.5FeO4 ~ 10FeSO47H2O,所以理论上n(FeSO47H2O)= 10n(Cr2O72-)=5.00×10-3mol ×10= 0.05mol,所以m(FeSO47H2O) = 0.05mol ×278g/mol = 13.9g,
故答案为:13.9。