题目内容
常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。
下列叙述中不正确的是
下列叙述中不正确的是
| A.常温下,pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,前者pH变化小 |
| B.等温下,等浓度的CH3COONa和NaCN溶液pH,后者大 |
| C.HCN溶液和NaOH溶液不等体积混合后一定存在C(H+)―C(OH-)=C(CN-)―C(Na+) |
| D.溶液中由水电离出的C(H+),前者是后者的10m-n倍 |
A
试题分析:常温下,浓度均为0.1mol/L CH3COOH溶液和HCN溶液的pH分别为m和n(1<m<n)。m<n ,说明醋酸的酸性强,A、pH相同的CH3COOH溶液和HCN溶液分别加水稀释相同的倍数时,酸性较弱的一方受平衡影响程度大,电离平衡正向移动,后者pH变化范围小,错误;B、越弱越水解,NaCN溶液水解程度大,pH值大,正确;C、HCN溶液和NaOH溶液不等体积混合,也一定存在电荷守恒,C(H+)+C(Na+)=C(CN-)+C(OH-),正确;D、溶液中由水电离出的C(H+),CH3COOH溶液中是10-(14-m),HCN溶液中是10-(14-n),正确。

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目



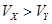
 不变
不变