题目内容
【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因:______________________________。
②在NaHA水溶液中各离子浓度的大小关系是:______________________________。
(2)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K=______。
②H 2SO3溶液和NaHCO3溶液反应的主要离子方程式为______。
【答案】 HA-+H2O![]() H2A+OH- c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-)
H2A+OH- c(Na+)>c(HA-)>c(OH-)>c(H+)>c(A2-) ![]() H2SO3+HCO
H2SO3+HCO![]() =HSO
=HSO![]() +CO2↑+H2O
+CO2↑+H2O
【解析】(1)NaHA溶液中存在三个平衡:水解平衡HA﹣+H2OH2A+OH﹣;电离平衡HA﹣A2-+H+,水的电离平衡H2OH++OH﹣,溶液呈碱性说明OH﹣大于H+浓度,所以,HA﹣的水解程度大于HA﹣的电离程度。
①水解导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性,水解方程式为:HA﹣+H2OH2A+OH﹣,故答案为:HA﹣+H2OH2A+OH﹣。
②Na+不水解,所以离子浓度最大;溶液呈碱性,则c(OH﹣)>c(H+);溶液中H+来自于H2O和HA﹣的电离,而A2-仅来自于HA﹣的电离,所以c(H+)>c(A2-);电离和水解都较微弱,溶质离子大于显性离子,所以c(HA﹣)>c(OH﹣)。故离子浓度大小顺序是c(Na+)>c(HA﹣)>c(OH﹣)>c(H+)>c(A2﹣)。
(2)①HSO3﹣的电离方程式为:HSO3﹣SO32﹣+H+,电离常数表达式为: 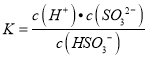
②由表可知,H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O;

 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案