题目内容
13.下列离子方程式书写正确的是( )| A. | 稀 H2SO4与铁粉反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 铜跟硝酸银溶液反应:Cu+Ag+=Cu2++Ag | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | Ba(OH)2与CuSO4溶液反应:Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓ |
分析 A.反应生成硫酸亚铁和氢气;
B.反应生成硝酸铜和Ag,电子、电荷不守恒;
C.碳酸钙在离子反应中保留化学式;
D.反应生成氢氧化铜和硫酸钡.
解答 解:A.稀 H2SO4与铁粉反应的离子反应为Fe+2H+=Fe2++H2↑,故A错误;
B.铜跟硝酸银溶液反应的离子反应为Cu+2Ag+=Cu2++2Ag,故B错误;
C.碳酸钙与盐酸反应的离子反应为CaCO3+2H+=Ca2++CO2↑+H2O,故C错误;
D.Ba(OH)2与CuSO4溶液反应的离子反应为Cu2++SO42-+Ba2++2OH-=BaSO4↓+Cu(OH)2↓,故D正确;
故选D.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电荷守恒,题目难度不大.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
4.下列有关化学实验的叙述正确的是( )
| A. | 在耐高温的石英坩埚中进行熔化氢氧化钠固体的实验 | |
| B. | 欲配制质量分数为10%的硫酸铜溶液,可准确称取10 g硫酸铜晶体溶于90 g水中 | |
| C. | 实验室可以用湿润的淀粉KI试纸鉴别二氧化氮和溴蒸气 | |
| D. | 从碘的CCl4溶液获得单质碘的实验方法是蒸馏 |
8.已知甲、乙、丙是中学常见的三种气体单质,相互间反应可制得化肥B.其转化关系如图1所示:
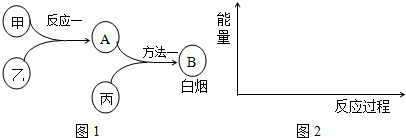
ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
(2)已知反应一是放热反应,画出能量关系示意图2.
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.

ⅠAⅡAⅢAⅣAⅤAⅥAⅦA0周期族
(1)将B中所含元素填写在如表的恰当位置中(用元素符号表示)
| 1 | ||||||||
| 2 | ||||||||
| 3 |
(3)为加快反应一的速率,可采取的措施有:适当升高温度、选用恰当的催化剂、增大某一反应物的浓度和增大压强.
(4)方法一的化学方程式是3Cl2+8NH3=N2+6NH4Cl.
(5)用方法二也能制得B:甲和丙反应的产物与A反应即可,这两种方法更好的是方法二(填“方
法一”或“方法二”),理由是方法二的原子利用率100%,零排放,符合绿色化学理念.
18.相同温度下,体积均为1L的两个恒容密闭容器中发生可逆反应:A(g)+2B(g)?2C(g)△H=a kJ•mol-1.(a>0),实验测得起始、平衡时的有关数据如下表所示,下列叙述错误的是( )
| 容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时 体系能量的变化 | ||
| A | B | C | ||
| ① | 1 | 2 | 0 | 吸收热量:0.25akJ |
| ② | 0.5 | 1 | 1 | 吸收热量:Q kJ |
| A. | 容器①、②中反应的平衡常数相等 | |
| B. | 平衡时,两个容器中C的体积分数均约为18% | |
| C. | 容器②中达到平衡时吸收的热量Q=0.25a kJ | |
| D. | 若其他条件不变,把容器①的体积改为2L,则平衡时吸收的热量小于0.25a kJ |
2.下列物质中属于还原性糖,能水解且最终产物为一种物质的是( )
| A. | 蔗糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 纤维素 |
