题目内容
18.常温下,取浓度相等的NaOH和HCl溶液,以3:1体积比相混和,所得溶液的pH等于l2,则原溶液的浓度为( )| A. | 0.01mol/L | B. | 0.017mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
分析 常温下,pH=12的溶液呈碱性,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,设原来溶液浓度为xmol/L,NaOH和HCl溶液以3:1的体积比混合,混合溶液中c(OH-)=$\frac{(3-1)x}{3+1}mol/L$,据此计算.
解答 解:常温下,pH=12的溶液呈碱性,溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=0.01mol/L,设原来溶液浓度为xmol/L,NaOH和HCl溶液以3:1的体积比混合,混合溶液中c(OH-)=$\frac{(3-1)x}{3+1}mol/L$=0.01mol/L,x=0.02,故选C.
点评 本题以酸碱混合为载体考查pH的有关计算,明确溶液中氢氧根离子计算方法是解本题关键,侧重考查分析计算能力,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.下列说法中正确的是( )
| A. | 在化学反应中一定有新物质生成,同时也一定有能量的变化 | |
| B. | 在化学反应中一定有新物质生成,但不一定有能量的变化 | |
| C. | 在化学反应中不一定有化学键的变化 | |
| D. | 在化学反应中一定有化学键的变化,但不一定有能量的变化 |
9.下列叙述中,正确的是( )
| A. | 化学反应中物质变化的实质是旧化学键的断裂和新化学键的形成 | |
| B. | 离子化合物中一定含有金属元素 | |
| C. | 化学键是物质中原子间强烈的相互作用 | |
| D. | 共价化合物中各原子都一定满足最外层8电子稳定结构 |
6.食品香精菠萝酯的生产路线(反应条件略去)如图:
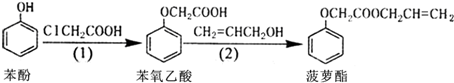
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 苯酚和菠萝酯均可与酸性KMnO4溶液发生反应 | |
| B. | 苯酚、苯氧乙酸和菠萝酯均可与NaOH溶液发生反应 | |
| C. | 步骤(1)中由苯酚生成苯氧乙酸的反应属于取代反应 | |
| D. | 步骤(2)产物中残留的烯丙醇(CH2=CHCH2OH)可用溴水检验 |
10.将某溶液逐滴加入到Fe(OH)3胶体内,开始出现沉淀,继续滴加时沉淀又溶解,该溶液是( )
| A. | 2mol/LH2SO4溶液 | B. | 2mol/LNaOH溶液 | ||
| C. | 2mol/LMgSO4溶液 | D. | 硅酸溶胶(胶体粒子带负电荷) |
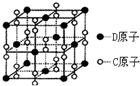 已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答:
已知A、B、C、D、E都是元素周期表中的前36号元素,它们的原子序数依次增大.B原子基态时P原子轨道上有3个未成对电子,其最高正价与最低负价代数和为2,C的价层电子排布式为ns2npn+2,其氢化物是同族元素所形成的氢化物中沸点最大.化合物AC2为非极性分子,D元素的原子核外共有20种不同运动状态的电子.E是元素周期表第四周期第9列元素.请回答: