题目内容
关于小苏打水溶液的表述正确的是( )
| A、存在的电离有:NaHCO3=Na++HCO3-,HCO3-=H++CO32- |
| B、c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| C、HCO3-的电离程度大于HCO3-的水解程度 |
| D、c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:碳酸氢钠是强碱弱酸酸式盐,碳酸氢根离子水解程度大于电离程度,导致溶液呈碱性,溶液中存在电荷守恒和物料守恒,据此分析解答.
解答:
解:A.碳酸氢钠是强电解质,在水溶液里完全电离,碳酸氢根离子是弱电解质,部分电离,所以电离方程式为NaHCO3=Na++HCO3-、HCO3-?H++CO32-,故A错误;
B.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.溶液呈碱性,则HCO3-的电离程度小于HCO3-的水解程度,故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
B.溶液中存在物料守恒,根据物料守恒得c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3),故B正确;
C.溶液呈碱性,则HCO3-的电离程度小于HCO3-的水解程度,故C错误;
D.溶液中存在电荷守恒,根据电荷守恒得c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-),故D错误;
故选B.
点评:本题考查了盐类水解中离子浓度大小比较,根据溶液中的溶质及其性质再结合守恒思想分析解答,注意碳酸氢根离子水解和电离都必须写可逆号,为易错点.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
下列说法不正确的是( )
| A、化学反应除了生成新物质外,还伴随着能量的变化 |
| B、物质燃烧和中和反应均放出热量 |
| C、分解反应肯定是吸热反应 |
| D、化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量 |
除去下列物质中的少量杂质(括号内为杂质),所选试剂和分离方法合理的是( )
| A、苯(苯酚):溴水、过滤 |
| B、CO2气体(HCl):饱和Na2CO3溶液、洗气 |
| C、淀粉(氯化钠):蒸馏水、渗析 |
| D、水(Br2):乙醇、分液 |
下列说法正确的是( )
| A、键能越大,表示该分子越容易受热分解 |
| B、共价键都具有方向性 |
| C、在分子中,两个成键的原子间的距离叫键长 |
| D、H-Cl的键能为431.8kJ?mol-1,H-Br的键能为366kJ?mol-1,说明HCl比HBr分子稳定 |
我国政府规定,国内销售的食盐必须加碘.关于加碘的下列叙述中不正确的是( )
| A、加碘食盐开袋后,不宜长期放置后食用 |
| B、加碘食盐中不能同时加碘化钾和碘酸钾 |
| C、加碘食盐中加入的是单质碘 |
| D、加碘食盐中加入是碘酸钾 |
下列反应的离子方程式书写正确的是( )
| A、氯气与水反应:Cl2+H2O═2H++Cl-+ClO- | ||||
| B、单质铜与稀硝酸反应:Cu+2H++2NO3═Cu2++2NO↑+H2O | ||||
C、浓盐酸与二氧化锰共热:MnO2+4H++2Cl-
| ||||
D、单质铜与浓硫酸共热:Cu+4H++SO42-
|
利用反应2CO+2NO?N2+2CO2可净化汽车尾气,下列关于该反应的描述正确的是( )
| A、加入含有18O的C18O,则体系中含有18O的物质只有C18O和C18O2 |
| B、使用适当的催化剂,可使CO和NO完全转化为N2和CO2 |
| C、若在固定容积的容器中反应,压强不变则说明达到平衡状态 |
| D、若CO浓度与CO2浓度相同时,达到平衡状态 |
关于分子式为C5H10的烯烃的下列说法正确的是( )
| A、该烯烃的一种同分异构体为CH2=CHCH(CH3)2名称为2-甲基-3-丁烯 |
| B、其属于烯烃的同分异构体有5种 |
| C、有一种同分异构体的名称为:2,2-二甲基-1-丙烯 |
| D、该物质的结构简式最多有两个侧链 |
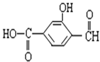 具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团:
具有复合官能团的复杂有机物:官能团具有各自的独立性,在不同条件下所发生的化学性质可分别从各官能团讨论.如:具有三个官能团: