题目内容
【题目】Ⅰ.某烷烃![]() 与烯烃
与烯烃![]() 的混合气体
的混合气体![]() ,其密度为同状况下
,其密度为同状况下![]() 密度的11.2倍,将混合气体通过足量的溴水,溴水增重
密度的11.2倍,将混合气体通过足量的溴水,溴水增重![]() ,回答下列问题:
,回答下列问题:
(1)写出结构简式:![]() ________,
________,![]() ________。
________。
(2)![]() 与丁烯互为________(填“同分异构体”或“同系物”)。
与丁烯互为________(填“同分异构体”或“同系物”)。
(3)写出![]() 与溴水反应的化学方程式:________________。
与溴水反应的化学方程式:________________。
(4)下列有关![]() 的结构或性质的说法正确的是________(填序号)。
的结构或性质的说法正确的是________(填序号)。
A 不能使酸性高锰酸钾溶液褪色,但能使溴的四氯化碳溶液褪色
B 分子中所有原子都在同一平面上
C 分子中有7个单键
D 与![]() 在一定条件下能加成并只得到一种产物
在一定条件下能加成并只得到一种产物
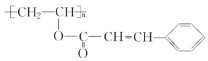
Ⅱ.(5)已知甲苯(![]() )能使酸性
)能使酸性![]() 溶液褪色。某有机物的结构简式为
溶液褪色。某有机物的结构简式为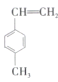 ,下列说法正确的是________(填序号)。
,下列说法正确的是________(填序号)。
A 该有机物使溴水褪色和在催化剂作用下与液溴反应原理一样
B 能用酸性![]() 溶液判断分子中存在碳碳双键
溶液判断分子中存在碳碳双键
C 该有机物在一定条件下与浓硝酸发生反应生成的苯环上的一硝基取代物可能有3种
D ![]() 该有机物在一定条件下最多与
该有机物在一定条件下最多与![]() 发生加成反应
发生加成反应
【答案】![]()
![]() 同系物
同系物 ![]() C D
C D
【解析】
(1)根据混合气体平均分子质量计算烷烃和烯烃物质的名称及其物质的量;
(2)根据同系物概念判断;
(3)根据烯烃的加成反应书写反应方程式;
(4)根据丙烯的性质进行分析。
Ⅰ.(1)混合气体的平均相对分子质量为![]() ,所以混合气体中烷烃
,所以混合气体中烷烃![]() 是甲烷,且其物质的量
是甲烷,且其物质的量![]() 0.3mol,而混合气体的物质的量
0.3mol,而混合气体的物质的量![]()
![]() ,故烯烃B的物质的量为
,故烯烃B的物质的量为![]() ,因此烯烃
,因此烯烃![]() 的相对分子质量=
的相对分子质量=![]() =42,烯烃
=42,烯烃![]() 所含碳原子数=
所含碳原子数=![]() =3,则烯烃
=3,则烯烃![]() 的分子式为
的分子式为![]() ,结构简式为
,结构简式为![]() ,g故答案:
,g故答案:![]() ;
;![]() ;
;
(2)根据上述分析可知![]() 为丙烯,与丁烯互为同系物,故答案:同系物;
为丙烯,与丁烯互为同系物,故答案:同系物;
(3)丙烯能与溴水发生加成反应,反应的化学方程式为![]() ,故答案:
,故答案:![]() ;
;
(4) A.丙烯与乙烯都含有碳碳双键,性质有相似之处,因此,丙烯同样能使酸性高锰酸钾溶液褪色,也能与渙发生加成反应,故A错误;
B.丙烯中含有![]() ,所以分子中所有原子不可能在同一平面上,故B错误;
,所以分子中所有原子不可能在同一平面上,故B错误;
C.丙烯中有7个单键,故C正确;
D.![]() 与
与![]() 加成,由于氯原子连接的位置有两种情况,加成产物也有两种,即
加成,由于氯原子连接的位置有两种情况,加成产物也有两种,即![]() 和
和![]() ,它们互为同分异构体,而不是同一物质,故D错误;
,它们互为同分异构体,而不是同一物质,故D错误;
故答案:C。
Ⅱ.(5)A.该有机物含有碳碳双键,可与![]() 发生加成反应导致溴水褪色,在催化剂作用下苯环上的氢与溴发生取代反应,二者反应原理不一样,故A错误;
发生加成反应导致溴水褪色,在催化剂作用下苯环上的氢与溴发生取代反应,二者反应原理不一样,故A错误;
B.由于苯环上连接有![]() ,该
,该![]() 能被酸性
能被酸性![]() 溶液氧化导致酸性
溶液氧化导致酸性![]() 溶液褪色,所以不能用酸性
溶液褪色,所以不能用酸性![]() 溶液判断该有机物中含有碳碳双键,故B错误;
溶液判断该有机物中含有碳碳双键,故B错误;
C.该有机物与浓硝酸反应生成的苯环上的一硝基取代物有2种, 故C错误;
D.该有机物中的苯环和![]() 均可与
均可与![]() 发生反应,
发生反应,![]() 该有机物最多可与
该有机物最多可与![]() 加成, 故D正确;
加成, 故D正确;
故答案:D。

【题目】某实验小组学习过氧化钠与水的反应时,向滴有酚酞的水中加入过氧化钠,发现溶液先变红后褪色,对此产生兴趣并进行研究。
(1)写出Na2O2与水反应的化学方程式:______。
(2)甲同学查阅资料:红色褪去的原因是H2O2在碱性条件下氧化了酚酞。
①甲同学通过实验证实了Na2O2与水反应所得溶液中有较多的H2O2:取少量反应所得溶液,加入试剂______(填化学式),有气体产生。
②甲同学利用3% H2O2溶液、酚酞试液、1mol·L-1 NaOH溶液,证实了碱性条件是必需的。
操作 | 现象 | |
实验1 | 向2mL 3%H2O2溶液中加入3滴酚酞试液,振荡,静置5min,再加入5滴1mol·L-1 NaOH溶液 | 观察到______。 |
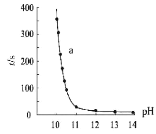
(3)为了更深入地了解该原理,甲同学继续查阅资料,发现H2O2溶液中相关微粒的物质的量分数X(i)与溶液pH的关系如图所示。
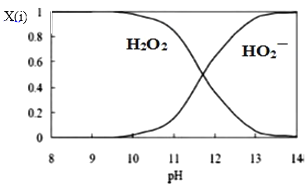
据此,甲同学设计实验2继续研究:
操作 | 现象 | |
实验2 | i.配制20mL 3%H2O2与NaOH的混合溶液,调节pH分别为10~14。 ii.滴入3滴酚酞试液,搅拌后静置,记录酚酞完全褪色的时间 | 得到如图所示实验结果:
|
甲同学由此提出假设I:溶液褪色的主要原因是酚酞被HO![]() 氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
氧化,请结合化学反应速率和化学平衡的相关知识解释此假设:_____。
(4)乙同学查阅资料,发现酚酞(以H2L表示)在不同pH条件下存在多种结构之间的变化:
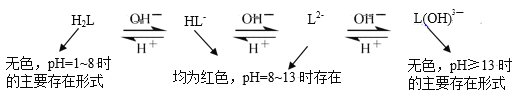
由此提出,甲同学实验2中pH13时红色褪去的原因还存在假设II:_____。
(5)针对假设I、II,小组同学设计了如下实验:
试剂加入顺序 | 现象 | |
实验3 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入3滴酚酞试液 | 溶液变红,然后褪色 |
iii.搅拌、静置后加入2mL 30% H2O2溶液 | _____ | |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 溶液变红,然后褪色 | |
实验4 | i.烧杯中加入10mL 2mol·L-1 NaOH溶液、8mL H2O ii.加入2mL 30% H2O2溶液 iii.搅拌、静置后加入3滴酚酞试液 | 溶液变红,然后褪色 |
iv.向褪色后的溶液中加入盐酸调节pH至12 | 不变红 |
①与L2-和HL-相比较,L(OH)![]() 比前两者更_____被氧化(填“难”或“易”)。
比前两者更_____被氧化(填“难”或“易”)。
②实验3中调节pH至12,溶液变红然后褪色的原因是:_____。
③根据实验得出结论:甲同学实验2中pH13时红色褪去的主要原因是_____(填“假设I”或“假设II”),请依据实验现象阐述理由:_____。
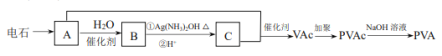
【题目】从某废液(含有Fe2+、Cu2+、Cl-)中回收铜并制得纯净的FeCl3溶液。现以制得纯净的FeCl3溶液为原料制取优良的水处理剂高铁酸钾(K2FeO4),其流程如下:

已知:高锰酸钾(K2FeO4)位暗紫色固体,可溶于水。在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。高锰酸钾具有强氧化性。高锰酸钾(K2FeO4)与水作用产生Fe(OH)3。
(1)检验废液中含有Fe2+选用的试剂是________(填化学式);从废液中制得纯净的FeCl3溶液加入的试剂除铁粉外,还需要一种试剂是_________(填化学式),加入时发生反应的离子方程式为__________。
(2)高锰酸钾(K2FeO4)在处理水过程中的作用是_________和__________。
(3)“氧化”过程反应的离子方程式为__________。
(4)过滤时需用的玻璃仪器有玻璃棒、烧杯和________,上述工艺得到的高锰酸钾常含有杂志,可用重结晶法提纯,操作是:将粗产品用_________溶解,然后________。
(5)用回收的铜为原料可制得粗制CuSO4·5H2O晶体(含有少量的FeSO4·7H2O),除去CuSO4·5H2O晶体中杂志的方法是:向溶液中加入H2O2,再调解溶液PH,过滤即可制得纯净的CuSO4溶液,进而制得纯净CuSO4·5H2O的晶体。
已知:室温时一些物质的Kaq如下表:
化学式 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
Kaq | 8.0×10-16 | 8.0×10-18 | 8.0×10-20 |
已知溶液中的离子浓度小于1×10-6mol·L-1时就认定沉淀完全。
加双氧水的目的是__________;若溶液中CuSO4的浓度为3.0mol·L-1,通过计算说明此方法可除去粗制CuSO4·5H2O晶体中FeSO4·7H2O的理由________。