题目内容
【题目】用下图装置可以完成一系列实验(图中夹持装置及加热装置已略去),不考虑①②③中物质间的相互影响。请回答下列问题:
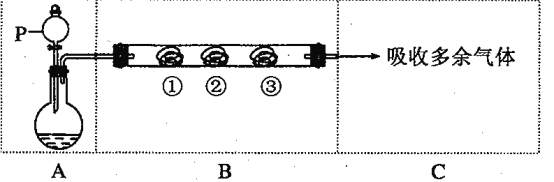
(1)若装置A选用浓盐酸和二氧化锰混合制取Cl2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | 石蕊溶液 | 淀粉KI溶液 | 浓氨水 |
现象 | ________ | ________ | ________ |
涉及的化学方程式 | ________ | ________ | 3Cl2+8NH3=6NH4Cl+N2 |
(2)若装置A选用浓硫酸和亚硫酸钠固体制取SO2气体,装置B中的三处棉花依次做了如下处理。请填写表中空白:
B中棉花的位置 | ① | ② | ③ |
所蘸试剂 | H2S溶液 | 酸性KMnO4溶液 | 品红溶液 |
现象 | ________ | ________ | 褪色 |
体现SO2的性质 | ________ | ________ | ________ |
【答案】先变红后褪色 变蓝 产生白烟 Cl2+H2OHCl+HClO Cl2+2KI=2KCl+I2 黄色物质产生 褪色 氧化性 还原性 漂白性
【解析】
根据氯气和二氧化硫的性质,结合图示分析实验中发生的化学反应及实验现象。
(1)因Cl2能与水反应生成HCl和HClO,HCl具有酸性,能使石蕊溶液变红,HClO具有强氧化性能使红色褪去,涉及的反应为:Cl2+H2OHCl+HClO;氯气与碘化钾溶液反应:Cl2+2KI=2KCl+I2,碘单质使淀粉变蓝;氯气与浓氨水挥发出的氨气反应生成氯化铵晶体,所以看到白烟,
故答案为:先变红后褪色;变蓝;产生白烟;Cl2+H2OHCl+HClO;Cl2+2KI=2KCl+I2;
(2)二氧化硫与硫化氢反应生成硫单质和水,二氧化硫中的硫元素化合价降低,体现氧化性,现象是有黄色物质产生;高锰酸钾有强氧化性,可以被二氧化硫还原,体现二氧化硫的还原性,现象是褪色;二氧化硫可以使品红褪色,体现二氧化硫的漂白性,
故答案为:黄色物质产生;褪色;氧化性;还原性;漂白性。

 学业测评一课一测系列答案
学业测评一课一测系列答案