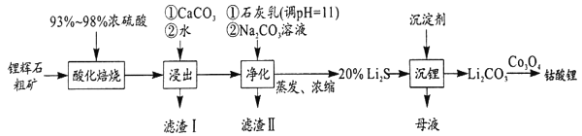
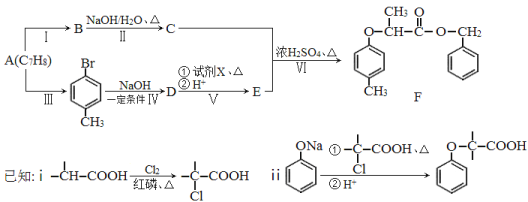
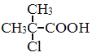题目内容
【题目】举世瞩目的中国探月工程三期再入返回试验器于2014年10月24日凌晨成功发射,为实现月球采样和首次地月往返踏出了成功的第一步。探月工程三期的主要目标是实现无人自动采样返回,突破月面采样、月面上升、月球轨道交会对接等核心关键技术。已知所用火箭推进剂为肼 (N2H4)和过氧化氢(H2O2),火箭箭体一般采用钛合金材料。
请回答下列问题:
(1)N2H4、H2O2分子中电负性最大的元素在周期表中的位置为_______,第一电离能最大的元素为_______。
(2)钛的原子序数为22,其基态电子排布式示意图为________________。
(3)1 mol N2H4分子中含有的键数目为_______。
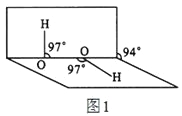
(4)H2O2分子结构如图1,其中心原子杂化轨道为_______,估计它难溶于CS2,简要说明原因___________。
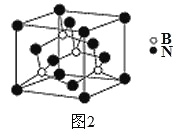
(5)氮化硼其晶胞如图2所示,则处于晶胞顶点上的原子的配位数为___,若立方氮化硼的密度为ρ g·cm-3,阿伏加德罗常数为NA,则两个最近N原子间的距离为________cm。
【答案】第二周期ⅥA族 N 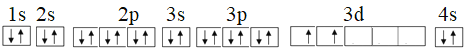 3.01×1024 sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中 4
3.01×1024 sp3 H2O2为极性分子,CS2为非极性溶剂,所以H2O2不能溶解在CS2中 4 
【解析】
(1)N2H4、H2O2共有H、O、N三种元素,根据非金属性越强,其电负性越大,可知O元素为电负性最大的元素,O元素位于周期表中第二周第ⅥA族。由于N原子2p3上的电子处于半充满状态,很难失去1个电子,所以第一电离能最大。
(2)Ti的原子序数为22,Ti原子核外有22个电子,根据核外电子排布规律和相关规则,其基态电子排布示意图为 。
。
(3)N2H4中的N原子满足8电子结构,H原子满足2电子结构,N2H4的分子结构简式为H2N―NH2,可见1molN2H4中含有5mol键,其数目=5×6.02×1023个=3.01×1024个。
(4)H2O2中中心原子为O原子,O原子成2个σ键,有2对孤对电子,原子杂化轨道数=键数+孤对电子对数=2+2=4,故H2O2分子的中心原子采用sp3杂化。由H2O2的结构可知,H2O2为极性分子,而CS2为非极性溶剂,根据“相似相容原理”,H2O2不能溶解在CS2中。
(5)根据“均摊法”可知,1个氮化硼晶胞中含有N原子数=8×1/8+6×1/2=4,B原子全部位于晶胞内,共4个B原子,化学式为BN,由于B原子周围距其最近有4个N原子,其配位数是4,所以处于晶胞顶点上的N原子的配位数也为4;一个晶胞的质量为![]() g,设该立方氮化硼晶胞的边长为acm,则1个立方氮化硼晶胞的体积是a3 cm3,因此ρ=
g,设该立方氮化硼晶胞的边长为acm,则1个立方氮化硼晶胞的体积是a3 cm3,因此ρ=![]() ,解得a=
,解得a=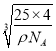 ,两个最近N原子间的距离是此晶胞面对角线的1/2,即为
,两个最近N原子间的距离是此晶胞面对角线的1/2,即为 。
。

【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O
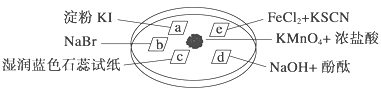
对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D