题目内容
【题目】向20mL0.5mol L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是
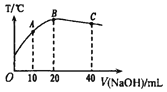
A. 由水电离出的c(H+):C点>B点
B. 醋酸的电离平衡常数:B点> A点
C. 从A点到B点,混合溶液中可能存在:c( CH3COO-) = c(Na+)
D. C 点混合溶液中一定存在:c(Na+) =2c(CH3COO-) +2c(CH3COOH)
【答案】A
【解析】中和反应是放热反应,在B点时恰好完全反应,B点为CH3COONa溶液,溶液显碱性,水的电离程度最大,故A错误;溶液温度最高时醋酸的电离平衡常数最大,醋酸的电离平衡常数:B点> A点,故B正确;;从A点到B点混合溶液可能显中性,依据电荷守恒可知c( CH3COO-) 可能等于 c(Na+),故C正确;在C点时为等浓度的CH3COONa、NaOH混合溶液,根据物料守恒,c(Na+) =2c(CH3COO-) +2c(CH3COOH),故D正确。

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目