题目内容
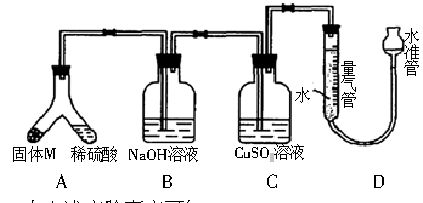
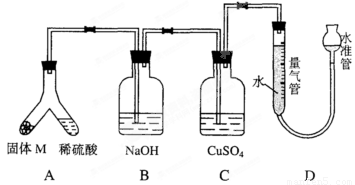
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如图装置。
倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化。反应后进入量气管气体的体积为V mL(已折算成标准状况)。
(1)由上述实验事实可知:
①固体M中一定有的物质是________________________________(填化学式),理由是____________________________________________________________________。
②其中一种物质的质量可以确定为___________g(用代数式表示)。
(2)B装置的名称是___________。
写出B装置中反应的离子方程式_____________________。
(3)C装置的作用是__________________,如果实验中没有B装置,则C装置中产生的现象是_____________________________________________________________。
(4)稀硫酸和固体M反应后溶液中还残留淡黄色固体,该固体是_______,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是____________________________________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是______________________。
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
解析:(1)①根据Fe与S在隔绝空气的条件下反应生成的固体与稀硫酸反应后,生成的H2S被NaOH溶液吸收,CuSO4溶液中又无变化,说明进入量气管的气体应该是H2,由此可以判断M固体中一定含有的物质是FeS、Fe。
②H2在标准状况下的体积为V mL,则固体M中Fe的质量为![]() ×
×![]() g。
g。
(2)B装置的名称是洗气瓶,NaOH溶液吸收H2S发生反应的离子方程式为2OH-+H2S![]() 2H2O+S2-。
2H2O+S2-。
(3)为了确定另一气体的成分,必须排除H2S的干扰,用CuSO4溶液可验证气体中是否还含有H2S:CuSO4+H2S![]() CuS↓+H2SO4,CuS为黑色沉淀。
CuS↓+H2SO4,CuS为黑色沉淀。
(4)残留固体为淡黄色,应为S,S不溶于水中,可通过过滤的方法将其分离,过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。
(5)M中有未反应的铁和硫,不影响实验;用装置D测定气体体积时,应将水准管和量气筒两边的水面处在一个水平面上,若高于量气管的水面,所测出的气体体积偏小;装置及导气管内存在残留气体也能使测定出的气体体积减少;气体干燥与否对气体体积的测量影响不大。
答案:(1)①FeS、Fe B装置增重、量气管中有气体 ②![]()
(2)洗气瓶 2OH-+H2S![]() 2H2O+S2-
2H2O+S2-
(3)证明H2S已被完全吸收 有黑色沉淀产生
(4)硫 漏斗、玻璃棒
(5)b、c

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案