题目内容
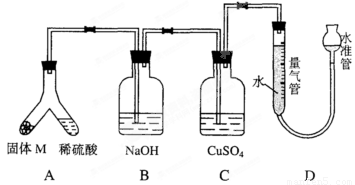
某课外兴趣小组为了探究铁与硫在隔绝空气的条件下反应所得固体M的成分,设计了如下图所示装置。倾斜A使稀硫酸(足量)与固体M充分反应,待反应停止后,B装置增重,C装置中溶液无变化,反应后进入量气管中气体的体积为VmL(已折算成标准状况)。
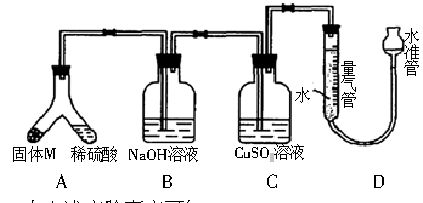
由上述实验事实可知:
(1)①固体M中一定有的物质是_______________(填化学式),理由是____________________________。
②其中一种物质的质量可以确定为_______g(用代数式表示)。
(2)B装置的名称是_______________,写出B装置中反应的离子方程式:_____________。
(3)C装置的作用是___________________,如果实验中没有B装置,则C装置中产生的现象是__________
______________________。
(4)稀硫酸和固体M反应后溶液中还残留有淡黄色固体,该固体是_____________,要分离出该固体,在实验操作中,除烧杯外还需要用到的玻璃仪器是________。
(5)通过进一步实验,测得固体M中各种成分的质量之和小于反应前铁粉和硫粉的质量之和,产生这种现象的原因可能是_____________。
a.M中有未反应的铁和硫
b.测定气体体积时水准管的水面高于量气管的水面
c.A中留有反应生成的气体
d.气体进入D装置前未用浓硫酸干燥
见解析
【试题分析】
解析:本题以硫化亚铁和铁为核心设计实验考查综合分析实验原理的能力。在隔绝空气的条件下将铁粉与硫粉混合加热,反应后固体成分中一定含有FeS,可能含有Fe或S,相关反应为Fe+S=FeS。
(1)因为氢氧化钠溶液增重,说明一定有H2S产生,推知M中一定有硫化亚铁;硫酸铜溶液无变化,说明硫化氢已被氢氧化钠溶液完全吸收,量气管里收集到的气体一定是氢气,推知M中有铁粉。根据氢气的体积可以计算出铁的质量:n(Fe)=n(H2)=(V/22400)mol,m(Fe)=(V/22400)mol×56g/mol=(V/400)g。(2)B装置为洗气瓶,可能发生反应的化学方程式为H2S+2NaOH=Na2S+2H2O,Na2S+H2S=2NaHS,NaOH+H2S=NaHS+H2O,但是可以认为B瓶中氢氧化钠过量。(3)因为硫化氢可溶于水,若氢气中混有硫化氢将影响氢气体积的测定,所以C装置用于检验H2S是否已除尽。若没有氢氧化钠溶液,H2S将与硫酸铜溶液反应产生黑色沉淀:H2S+CuSO4=CuS↓+H2SO4。(4)淡黄色固体是硫粉,用过滤法分离硫要用到的玻璃仪器有漏斗、玻璃棒和烧杯。(5)不考虑硫粉与铁粉反应得到固体M产生的误差,则题述现象源于测定M成分产生的误差。a项,若铁粉和硫粉没有反应完,通过测定氢气的体积可测定铁粉剩余的量,同时可直接测定硫过量的量,所以对M总质量的测定没有影响;b项,读氢气体积时,水准管中水面高于量气管里的水面,量气管里氢气受到的压强大于外压(增加了液压部分的压强),造成测定的氢气体积偏小,测定的铁粉质量偏低;c项,A管中残留有气体,必定造成测得的M质量偏小;d项,排水法收集氢气,氢气不需要干燥。故选bc。

练习册系列答案
 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目