��Ŀ����
����Ŀ��Ԫ�����ڱ��е������ڵĽ���Ԫ���������Ϳ������зdz���Ҫ��ʹ�ü�ֵ��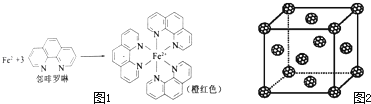
��1���ⶨ���������ĺ���ʱ���Ƚ���������ԭΪ���������ٲ����ڷ���������ɫ�����ñ�ɫ���ⶨ���������к��и�������ʱ��Բⶨ�и��ţ���صķ�Ӧ���£�4FeCl3+2NH2OHHCl��4FeCl2+N2O��+6HCl+H2O
��Fe2+�ڻ�̬ʱ����������Ų�ʽ��
���ǰ��У�NH2OH������SP3�ӻ���ԭ������
��Fe2+���ڷ������γɵ�������У���λ��Ϊ��
��2��������ͭ��Һ�м��������ˮ��Ȼ����������Ҵ�����Һ����������ɫ��[Cu��NH3��4]SO4���壬�þ����к��еĻ�ѧ����������
��3��������ͭ��Һ�м��������ˮ��������[Cu��NH3��4]2+ �� ��֪NF3��NH3�Ŀռ乹�Ͷ��������Σ���NF3 ������Cu2+�γ������ӣ���ԭ������
��4�������Ni��CO��4�����³�Һ̬��������CCl4�������л��ܼ�����̬Ni��CO��4�������壻
��5������Ѿ����������������������Χ�ɵĿ�϶�����������϶���������ڵ縺����С��ԭ�ӿ���Ϊ�������C60 ����Ŀ�϶�У��γɾ������õij����ԵIJ���C60 ������ְ�C60������ʵ㣬�þ���ľ����ṹ��ͼ2��ʾ����ÿ���������϶����һ��ԭ�ӣ���ȫ������C60 ������������϶�����γɵIJ���C60 ������Ļ�ѧʽΪ ��
���𰸡�
��1��ls22s22p63s23p63d6��[Ar]3d6��N��O��6
��2�����Ӽ������ۼ�����λ��
��3��F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ����NF3������Cu2+�γ�������
��4������
��5��K2C60
����������1��������26��Ԫ�أ���ԭ�Ӻ�����26�����ӣ���ԭ��ʧȥ2�����ӱ���������ӣ�Fe2+�ڻ�̬ʱ����������Ų�ʽΪls22s22p63s23p63d6��[Ar]3d6 �� ���Դ��ǣ�ls22s22p63s23p63d6��[Ar]3d6�����ǰ������У��۲���Ӷ�Ϊ4��ԭ����N��Oԭ�ӣ����Բ���sp3�ӻ���ԭ����N��Oԭ�ӣ����Դ��ǣ�N��O������λ����������λ��������һ���γ���ɼ�����λԭ�ӵ�����������Fe2+���ڷ������γɵ������γɹ�����ͼ1���У���λ��Ϊ6�����Դ��ǣ�6����2��Cu2+�ṩ�չ����Nԭ���ṩ�¶Ե��ӣ�Cu2+��NH3����֮���γ���λ����NH3������N��Hԭ��֮���Թ��ۼ���ϣ��Ƚ�����[Cu��NH3��4]2+���������SO42�������Ӽ���ϣ����Դ��ǣ����Ӽ������ۼ�����λ������3��N��F��H����Ԫ�صĵ縺�ԣ�F��N��H������NH3�й��õ��Ӷ�ƫ��N������NF3�У����õ��Ӷ�ƫ��F��ƫ��Nԭ�ӣ����Դ��ǣ�F�ĵ縺�Ա�N��N��F�ɼ����Ӷ���Fƫ�ƣ�����NF3��Nԭ�Ӻ˶���¶Ե��ӵ�����������ǿ�������γ���λ����NF3������Cu2+�γ������ӣ���4��Ni��CO��4������ΪҺ̬��������CCl4�������л��ܼ�����̬Ni��CO��4���ڷ��Ӿ��壬���Դ��ǣ����ӣ���5�����������У��ڳ��������Σ�Ȼ������ŵ��ĸ�������Χ�ɵĿ�϶���ͽ����������϶����ͼ��ʾ�� 
�����������ṹ�У�ÿ��С�������Ӧ1���������϶��һ����8�����������϶����ͼ����������һ�����������ڵ縺����С��ԭ����K�����Ծ�����һ����8��Kԭ�ӣ�1+6�� ![]() =4��C60���ӣ������ K8��C60��4 �� ��ѧʽΪK2C60 �� ���Դ��ǣ�K2C60 ��
=4��C60���ӣ������ K8��C60��4 �� ��ѧʽΪK2C60 �� ���Դ��ǣ�K2C60 ��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�