题目内容
依据事实,写出下列反应的热化学方程式。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
(1)1molC2H4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出1411kJ热量。
(2)1molC2H5OH(l)与适量O2(g)反应生成CO2(g)和H2O(l),放出1366.8kJ热量。
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8kJ热量。
(1)C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H=―1411kJ?mol-1
(2)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=―1366.8kJ?mol-1
(3)Al(s)+
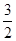 O2(g)=Al2O3(s) △H=―1669.8kJ?mol-1
O2(g)=Al2O3(s) △H=―1669.8kJ?mol-1试题分析:该题考查的是热化学方程式的书写,关于热化学方程式的书写要注意以下几点:(1)△H只能写在标有反应物和生成物状态的化学方程式的右(后)边,并用“;”隔开。若为放热反应,△H为“-”;若为吸热反应,△H为“+”。△H的单位一般为KJ/mol。
(2)反应热△H与测定条件(温度、压强等)有关。书写热化学方程式时,应注明△H的测定条件(温度、压强),未指明温度和压强的反应热△H,指25℃(298K)、101KPa时的反应热△H(绝大多数反应热△H是在25℃、101KPa时测定的)。
(3)物质本身具有的能量与物质的聚集状态有关。反应物和生成物的聚集状态不同,反应热△H的数值以及符号都可能不同。因此,必须注明物质(反应物和生成物)的聚集状态(气体-g液体-l固体-s稀溶液-aq),才能完整地体现出热化学方程式的意义。热化学方程式中,不用“↑”和“↓”。
(4)热化学方程式中,各物质化学式前的化学计量数,只表示该物质的物质的量,可以是整数、分数、或小数。对相同化学反应,化学计量数不同,反应热△H也不同。如:H2(g)+1/2O2(g)=H2O(g);△H=-241.8KJ/mol2H2(g)+O2(g)=2H2O(g);△H=-483.6KJ/mol。普通化学方程式中各物质化学式前的化学计量数,既可以表示该物质的物质的量,又可以表示该物质的微粒数,还可以表示同温同压时的体积。
(5)相同条件(温度、压强),相同物质的化学反应(互逆反应,不一定是可逆反应),正向进行的反应和逆向进行的反应,其反应热△H数值相等,符号相反。如:2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol2H2O(l)=2H2(g)+O2(g);△H=+571.6KJ/mol
(6)反应热△H的单位KJ/mol中的“/mol”是指该化学反应整个体系(即指“每摩化学反应”),而不是指该反应中的某种物质。如2H2(g)+O2(g)=2H2O(l);△H=-571.6KJ/mol指“每摩2H2(g)+O2(g)=2H2O(l)反应”,放出571.6KJ的能量,而不是指反应中的“H2(g)、O2(g)、或H2O(l)”的物质的量。
(7)不论化学反应是否可逆,热化学方程式中的反应热△H表示反应进行到底(完全转化)时的能量变化。如:2SO2(g)+O2(g)=2SO3(g);△H=-197KJ/mol是指2molSO2(g)和1molO2(g)完全转化为2molSO3(g)时放出的能量。若在相同的温度和压强时,向某容器中加入2molSO2(g)和1molO2(g)反应达到平衡时,放出的能量为Q,因反应不能完全转化生成2molSO3(g),故Q<197KJ。
(8)反应热的大小比较,只与反应热的数值有关,与“+”“-”符号无关。“+”“-”只表示吸热或放热,都是反应热。如2H2(g)+O2(g)=2H2O(g);△H1=-aKJ/mol2H2(g)+O2(g)=2H2O(l);△H2=-bKJ/mol两反应的反应热的关系为a<b,但△H1>△H2

练习册系列答案
相关题目

 2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题;
2NH3(g)△H<0其化学平衡常数K与温度t的关系如右表:请完成下列问题; 2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
2SO3(g),反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。
 。
。 
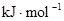
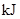
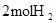 中的化学键
中的化学键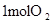 中的化学键
中的化学键 键
键