题目内容
【题目】下列各组物质熔化或升华时,所克服的粒子间作用属于同种类型的是( )
A. 氯化钠与蔗糖熔化B. 碘和干冰升华
C. 镁和硫熔化D. 金刚石与氧化钠熔化
【答案】B
【解析】
A.氯化钠熔化破坏离子键与蔗糖熔化破坏分子间作用力,故A错误;
B.碘和干冰升华均破坏的是分子间作用力,故B正确;
C.镁熔化破坏金属键和硫熔化破坏分子间作用力,故C错误;
D.金刚石熔化破坏共价键与氧化钠熔化破坏离子键,故D错误;
答案:B

 应用题作业本系列答案
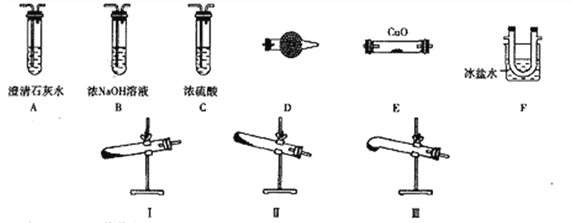
应用题作业本系列答案【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
【题目】某学生探究如下实验(A):
实验A | 条件 | 现象 |
| 加热 | i.加热后蓝色褪去 ii.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
(1)使淀粉变蓝的物质是____。
(2)分析现象i、ii认为:在酸性条件下,加热促进淀粉水解,冷却后平衡逆向移动。
设计实验如下,“现象a”证实该分析不合理:
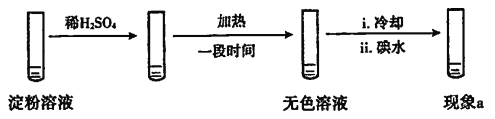
“现象a”是____。
(3)再次分析:加热后单质碘发生了变化,实验如下:
I:取少量碘水,加热至褪色,用淀粉溶液检验挥发出的物质,变蓝。
Ⅱ:向褪色后的溶液中滴加淀粉溶液,冷却过程中一直未变蓝;加入稀H2SO4,瞬间变蓝。
对步骤Ⅱ中稀H2SO4的作用,结合离子方程式,提出一种合理的解释:______________。
(4)探究碘水褪色后溶液的成分:
实验1:测得溶液的pH≈5
实验2:取褪色后的溶液,完成如下实验:
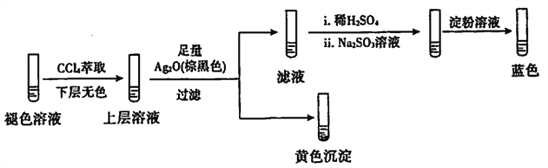
①产生黄色沉淀的离子方程式是____。
②Ag2O的作用是____________。
③依据上述实验,推测滤液中含有的物质(或离子)可能是_________。
(5)结合化学反应速率解释实验A中现象i、现象iii蓝色褪去的原因:_______________。